L’allopregnanolone (3α,5α-tetraidroprogesterone) è un neurosteroide derivato dal progesterone con potenti effetti sul sistema nervoso centrale. Agendo come un modulatore allosterico positivo del recettore GABA-A, l’allopregnanolone regola processi cognitivi, emozionali e neuroendocrini. Recenti ricerche hanno evidenziato il suo ruolo nella regolazione della dopamina e nei meccanismi patologici di condizioni come la sindrome post-finasteride (PFS). Questo articolo esplora la biosintesi dell’allopregnanolone, i meccanismi enzimatici coinvolti e il suo impatto clinico.
Biosintesi dell’Allopregnanolone: Steroidogenesi
L’allopregnanolone è prodotto attraverso la steroidogenesi, un processo biochimico che si svolge principalmente nelle gonadi, nelle ghiandole surrenali e nel sistema nervoso centrale. Il processo inizia con il colesterolo, la molecola precursore da cui derivano tutti gli steroidi.
Fasi principali della biosintesi:
Conversione del colesterolo in pregnenolone
Il colesterolo è trasportato nei mitocondri tramite la proteina STAR (Steroidogenic Acute Regulatory Protein).
L’enzima P450scc (CYP11A1) converte il colesterolo in pregnenolone attraverso una reazione di desmolasi.
Conversione del pregnenolone in progesterone
Nel reticolo endoplasmatico, il pregnenolone subisce un processo di ossidazione e isomerizzazione catalizzato dalla 3β-idrossisteroide deidrogenasi (3β-HSD).
Produzione di allopregnanolone dal progesterone
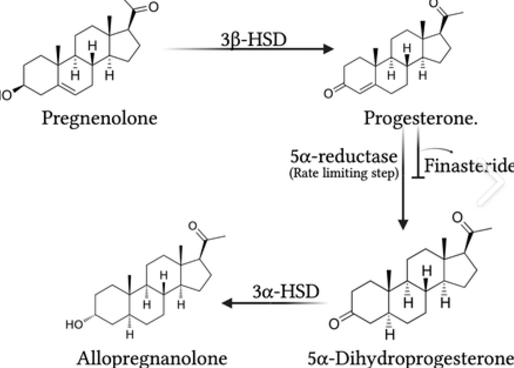
Il progesterone è ridotto dall’enzima 5α-reduttasi di tipo I e II a 5α-diidroprogesterone.
Successivamente, il 5α-diidroprogesterone è ulteriormente ridotto a allopregnanolone dall’enzima 3α-idrossisteroide deidrogenasi (3α-HSD).
Enzimi chiave nella biosintesi:
CYP11A1: Inizia il processo di steroidogenesi nel mitocondrio.
3β-HSD: Essenziale per la formazione del progesterone.
5α-Reduttasi: Converte il progesterone in 5α-diidroprogesterone; coinvolto anche nel metabolismo del testosterone.
3α-HSD: Catalizza la riduzione del 5α-diidroprogesterone in allopregnanolone.
Funzioni dell’Allopregnanolone nel Sistema Nervoso Centrale
L’allopregnanolone modula vari processi neurofisiologici attraverso i suoi effetti sul recettore GABA-A, il principale recettore inibitorio del sistema nervoso centrale. Stimolando l’attività del GABA-A, aumenta la conduttanza del cloro nei neuroni, riducendo l’eccitabilità neuronale. Questo meccanismo è alla base del suo effetto ansiolitico, antidepressivo e anticonvulsivante.
Ruolo nella regolazione della dopamina
L’allopregnanolone influenza indirettamente la neurotrasmissione dopaminergica.
Effetto GABAergico: La modulazione del recettore GABA-A contribuisce alla regolazione dell’attività dei neuroni dopaminergici nella substantia nigra e nell’area tegmentale ventrale.
Interazione con la neuroinfiammazione: L’allopregnanolone riduce la neuroinfiammazione e lo stress ossidativo, che possono alterare negativamente la sintesi e il rilascio di dopamina.
Ruolo nell’asse HPA (ipotalamo-ipofisi-surrene): Agisce come un regolatore negativo della reattività allo stress, proteggendo i circuiti dopaminergici da alterazioni croniche indotte dallo stress.
Una carenza di allopregnanolone può portare a disregolazioni della dopamina, con conseguenti sintomi come depressione, ansia e deficit cognitivi.
L’Allopregnanolone nella Sindrome Post-Finasteride
La sindrome post-finasteride (PFS) è una condizione complessa caratterizzata da sintomi neuropsichiatrici, sessuali e somatici, che emergono in alcuni pazienti dopo l’interruzione della finasteride, un inibitore della 5α-reduttasi utilizzato per trattare l’iperplasia prostatica benigna e l’alopecia androgenetica.
Meccanismo patologico della PFS:
Inibizione della 5α-reduttasi
La finasteride blocca la 5α-reduttasi, impedendo la conversione del progesterone in 5α-diidroprogesterone e, di conseguenza, in allopregnanolone. Questo porta a una riduzione dei livelli di neurosteroidi cruciali per il funzionamento del sistema nervoso centrale.
Deficit di allopregnanolone e dopamina
La ridotta sintesi di allopregnanolone diminuisce la modulazione GABAergica, aumentando l’eccitabilità neuronale.
La disfunzione dopaminergica risultante contribuisce ai sintomi neuropsichiatrici, come depressione, ansia e anedonia.
Alterazioni neuroendocrine
La carenza di allopregnanolone compromette l’asse HPA, accentuando la vulnerabilità allo stress e peggiorando i sintomi psicologici.
Neuroinfiammazione e stress ossidativo
L’inibizione cronica della 5α-reduttasi può promuovere uno stato pro-infiammatorio e di stress ossidativo, aggravando la neurotossicità e i deficit cognitivi.
Evidenze Cliniche e Terapie Sperimentali
Evidenze cliniche
Studi sui pazienti affetti da PFS hanno mostrato:
Livelli ridotti di neurosteroidi, inclusi allopregnanolone e pregnanolone.
Alterazioni nell’espressione del recettore GABA-A e nella funzione dopaminergica.
Sintomi cronici resistenti a trattamenti convenzionali.
Terapie sperimentali
Integrazione con neurosteroidi
L’uso di analoghi sintetici dell’allopregnanolone o di precursori della steroidogenesi (come il pregnenolone) è in fase di studio per ripristinare i livelli di neurosteroidi.
Modulazione del sistema GABAergico
Farmaci che potenziano l’attività del GABA-A possono alleviare i sintomi neuropsichiatrici.
Terapie antiossidanti e antinfiammatorie
Molecole come N-acetilcisteina e curcumina possono ridurre lo stress ossidativo e l’infiammazione.
Terapie per la regolazione dopaminergica
Agenti dopaminergici selettivi possono migliorare i deficit associati alla disregolazione della dopamina.
Conclusioni
L’allopregnanolone è un neurosteroide cruciale con implicazioni profonde per il benessere neuropsicologico e neuroendocrino. La sua carenza, come osservata nella sindrome post-finasteride, rivela l’importanza della steroidogenesi nella regolazione della dopamina e nella stabilità del sistema nervoso centrale. Approfondire la comprensione dei meccanismi molecolari e sviluppare interventi terapeutici mirati potrebbe offrire nuove prospettive per la gestione della PFS e di altre condizioni correlate.
4

