Vista l’importanza e l’attualità dell’argomento, ho ritenuto opportuno tradurre questo articolo per rendere le informazioni accessibili a un pubblico più ampio. Tuttavia, vi incoraggio vivamente a consultare l’articolo originale per un quadro completo e accurato. L’articolo può essere letto in inglese al seguente link: https://www.nejm.org/doi/full/10.1056/NEJMoa2206038
In breve, l’articolo discute dei risultati di uno studio clinico sulla tirzepatide, un farmaco in fase di sviluppo per il trattamento dell’obesità. Il farmaco è stato somministrato una volta alla settimana a dosi diverse ai partecipanti allo studio, e i suoi effetti sono stati confrontati con un placebo.
L’obesità è la malattia cronica più diffusa nel mondo, che colpisce circa 650 milioni di adulti. L’eccesso di adiposità e le sue numerose complicanze, tra cui malattie cardiovascolari e diabete di tipo 2, rappresentano un notevole onere economico e sono tra i principali contributi alla morbosità e mortalità globale. I trattamenti che risultano in notevoli riduzioni di peso possono migliorare la situazione delle persone che vivono con l’obesità.
Storicamente, il trattamento dell’obesità si è concentrato quasi esclusivamente su approcci basati sullo stile di vita. Tuttavia, è emerso che la dieta e l’esercizio fisico provocano meccanismi di controregolazione fisiologica che limitano la riduzione del peso e ostacolano il mantenimento del peso, portando alla consapevolezza che l’obesità è una malattia metabolica complessa e multicomponente dell’omeostasi energetica che coinvolge meccanismi centrali e periferici. Una volta presente l’obesità, tali meccanismi rendono difficile il ritorno a un peso inferiore. Pertanto, diverse linee guida cliniche ora raccomandano il trattamento con farmaci anti-obesità per le persone con obesità o per coloro con sovrappeso e complicanze relative al peso. Studi recenti con agonisti del recettore del peptide-1 simile al glucagone a lunga durata d’azione (GLP-1) hanno dimostrato che una maggiore efficacia con una sicurezza accettabile potrebbe essere ottenuta mirando ai percorsi degli ormoni stimolati da nutrienti endogeni. Il polipeptide insulinotropico dipendente dal glucosio (GIP), un altro ormone stimolato dai nutrienti, regola l’equilibrio energetico attraverso il segnalamento del recettore di superficie cellulare nel cervello e nel tessuto adiposo. Una molecola che combina sia l’agonismo GIP che GLP potrebbe teoricamente portare a una maggiore efficacia nella riduzione del peso.
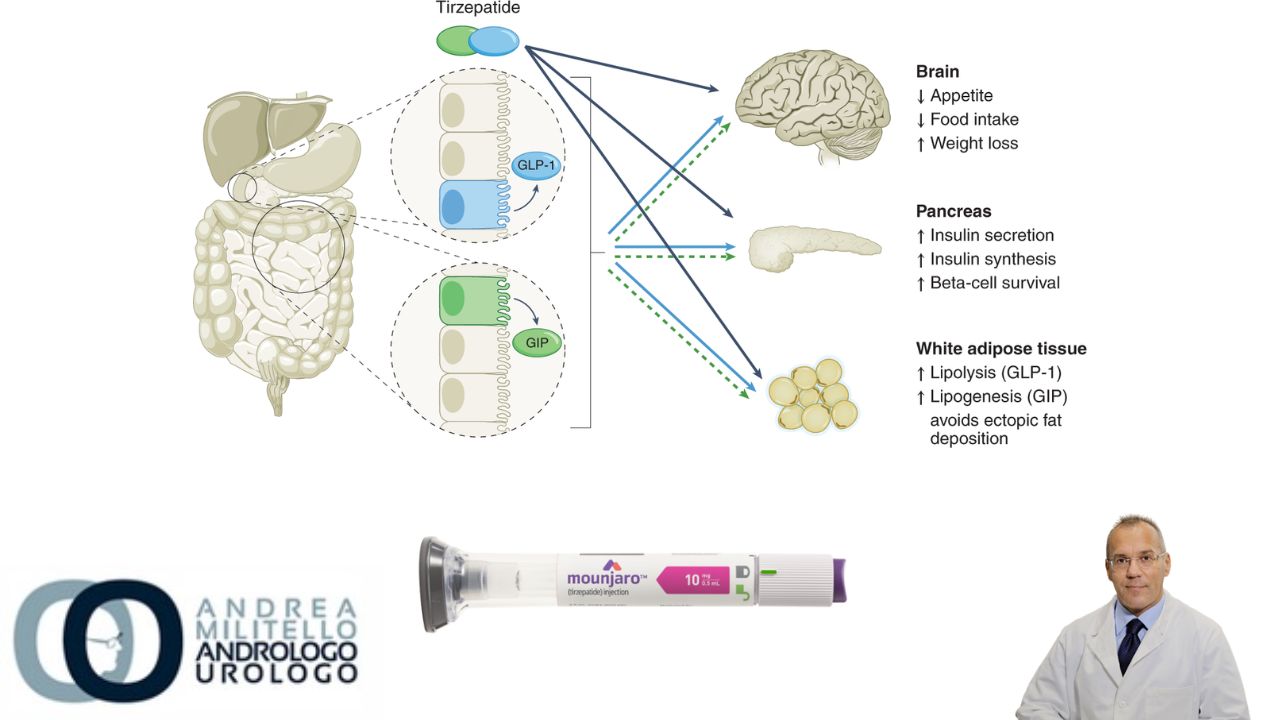
Il Tirzepatide è un peptide iniettabile sottocutaneo settimanale (approvato dalla Food and Drug Administration [FDA] per il diabete di tipo 2) ingegnerizzato dalla sequenza GIP nativa, con attività agonista sia sui recettori GIP che GLP-1.
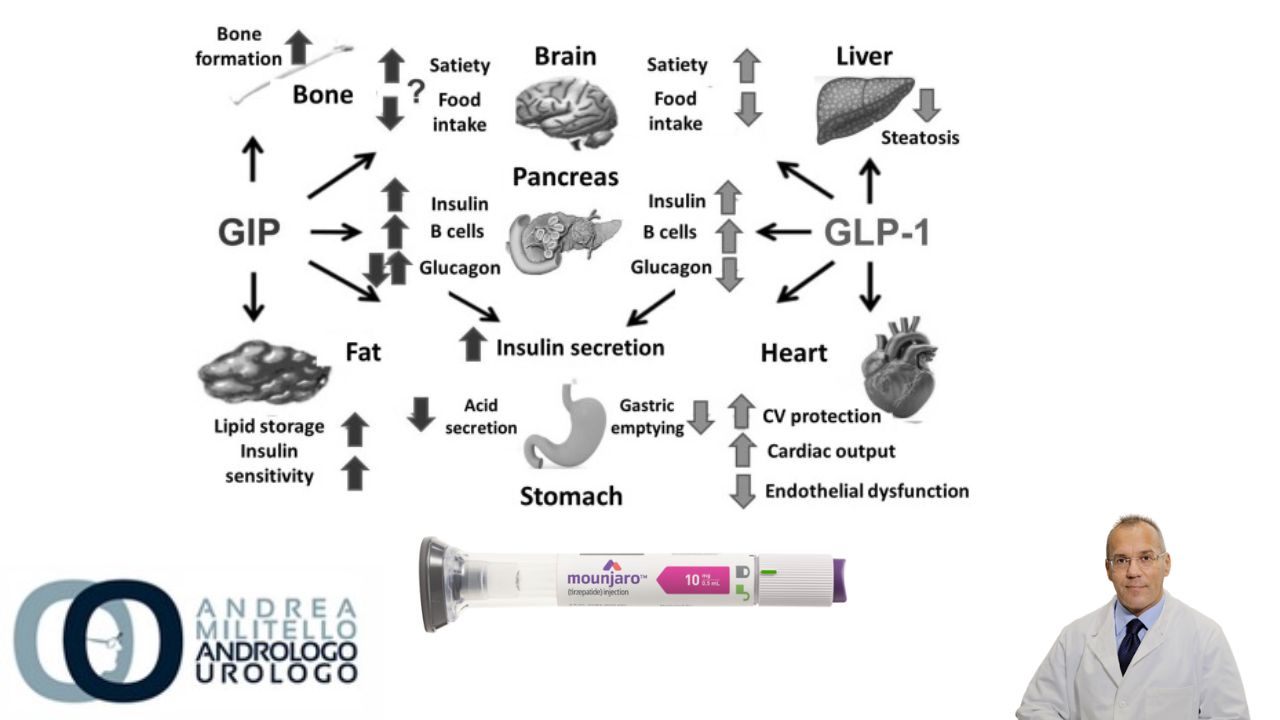
I dati preclinici hanno dimostrato che l’affinità del tirzepatide per i recettori GIP era pari all’affinità del GIP nativo per i recettori GIP, mentre il tirzepatide legava i recettori GLP-1 con un’affinità circa cinque volte più debole di quella del GLP-1 nativo per i recettori GLP-1. L’attivazione del GIP sembrava agire in modo sinergico con l’attivazione del recettore GLP-1 per consentire una maggiore riduzione del peso nei topi rispetto a quella ottenuta con il monoagonismo del recettore GLP-1. Nei studi di fase 2 su persone con diabete di tipo 2, il tirzepatide ha indotto una riduzione del peso clinicamente rilevante, giustificando ulteriori indagini per il trattamento dell’obesità. Il presente studio, SURMOUNT-1, ha valutato l’efficacia e la sicurezza del tirzepatide in adulti con obesità o sovrappeso che non avevano il diabete.
Metodi
PROGETTAZIONE DELLO STUDIO
Questo studio di fase 3, multicentrico, in doppio cieco, randomizzato, controllato con placebo, è stato condotto in 119 siti in nove paesi. Il protocollo è disponibile sul sito NEJM.org. Lo studio è stato condotto in conformità con i principi della Dichiarazione di Helsinki e le linee guida della Buona Pratica Clinica ed è stato approvato da un comitato etico indipendente o un comitato di revisione istituzionale presso ciascun sito di studio. Tutti i partecipanti hanno fornito il loro consenso informato scritto prima di partecipare. Lo sponsor (Eli Lilly) ha progettato e supervisionato la conduzione dello studio; gli investigatori del sito di studio erano responsabili della raccolta dei dati, e lo sponsor ha effettuato il monitoraggio del sito, la raccolta e l’analisi dei dati. Tutti gli autori hanno partecipato all’interpretazione dei dati e alla revisione critica del manoscritto. Gli investigatori lavoravano sotto accordi di riservatezza con lo sponsor; tutti gli autori avevano pieno accesso ai dati dello studio e garantiscono l’accuratezza e l’integrità dei dati e la fedeltà dello studio al protocollo.
PARTICIPANTI
Erano idonei a partecipare gli adulti di 18 anni o più, con un indice di massa corporea (BMI, il peso in chilogrammi diviso per il quadrato dell’altezza in metri) di 30 o più, o un BMI di 27 o più e almeno una complicazione legata al peso (ad es., ipertensione, dislipidemia, apnea ostruttiva del sonno o malattia cardiovascolare), e che riferivano uno o più tentativi dietetici infruttuosi per perdere peso. I criteri di esclusione principali erano il diabete, un cambiamento del peso corporeo di più di 5 kg nei 90 giorni precedenti lo screening, un precedente o pianificato trattamento chirurgico per l’obesità e il trattamento con un farmaco che promuove la perdita di peso nei 90 giorni precedenti lo screening. Un elenco completo dei criteri di ammissibilità è fornito nell’Appendice Supplementare.
PROCEDURE
Dopo un periodo di screening di 2 settimane, i partecipanti sono stati assegnati in modo casuale in un rapporto 1:1:1:1 a ricevere tirzepatide a una dose di 5 mg, 10 mg o 15 mg o un placebo, somministrato sottocutaneamente una volta alla settimana per 72 settimane come coadiuvante all’intervento sullo stile di vita
. L’intervento sullo stile di vita includeva regolari sedute di consulenza sullo stile di vita, condotte da un dietista o da un professionista sanitario qualificato, per aiutare i partecipanti a seguire pasti sani ed equilibrati, con un deficit di 500 calorie al giorno, e almeno 150 minuti di attività fisica alla settimana.
La randomizzazione del trattamento è stata stratificata per paese, sesso e presenza o assenza di prediabete, come definito dalle Norme di assistenza medica nel diabete 2019 dell’American Diabetes Association (vedi Appendice supplementare). Tutti i partecipanti assegnati in modo casuale dovevano sottoporsi a un periodo di trattamento programmato di 72 settimane che includeva un periodo di escalation della dose fino a 20 settimane. Il tirzepatide è stato iniziato con una dose di 2,5 mg una volta alla settimana (o placebo corrispondente) ed è stato aumentato di 2,5 mg ogni 4 settimane durante il periodo di escalation della dose per raggiungere una dose di mantenimento fino a 15 mg una volta alla settimana entro la 20ª settimana. Dopo il periodo di trattamento di 72 settimane, i partecipanti che non avevano avuto prediabete al momento della randomizzazione sono passati a un periodo di follow-up sulla sicurezza di 4 settimane; quelli con prediabete al momento della randomizzazione hanno continuato nel loro gruppo di trattamento originale per un ulteriore periodo di trattamento dello studio di 2 anni. Questo articolo riporta i risultati dalla fase di trattamento di 72 settimane (il periodo principale dello studio) e il follow-up sulla sicurezza di 4 settimane.
PUNTI FINALI E VALUTAZIONI
I punti finali coprimari erano la percentuale di cambiamento nel peso corporeo dalla baseline alla settimana 72 e una riduzione del peso del 5% o più alla settimana 72. I punti finali secondari chiave includevano una riduzione del peso del 10% o più, del 15% o più, e del 20% o più alla settimana 72; il cambiamento nel peso dalla baseline alla settimana 20; e il cambiamento dalla baseline alla settimana 72 nella circonferenza della vita, nella pressione arteriosa sistolica, nei livelli di insulina a digiuno e di lipidi, e nel punteggio di funzione fisica del questionario sulla salute a 36 voci (SF-36), versione 2, forma acuta. La percentuale di cambiamento nella massa totale di grasso corporeo dalla baseline alla settimana 72 è stata valutata in un sottogruppo di 255 partecipanti che hanno effettuato la densitometria a raggi X a doppia energia.
Le valutazioni di sicurezza includevano eventi avversi ed eventi avversi seri che si sono verificati durante il periodo di segnalazione. Le valutazioni di laboratorio sono state condotte secondo il protocollo (vedi Appendice Supplementare).
ANALISI STATISTICA
Abbiamo calcolato che un campione di 2400 partecipanti avrebbe fornito una potenza effettiva superiore al 90% per dimostrare la superiorità del tirzepatide (10 mg, 15 mg, o entrambi) rispetto al placebo, relativamente ai punti finali coprimari, ciascuno con un livello di significatività bilaterale di 0,025. Il calcolo della dimensione del campione presupponeva almeno un differenza dell’11 percento nel peso medio percentuale di riduzione dalla baseline a 72 settimane per il tirzepatide (10 mg, 15 mg, o entrambi) rispetto al placebo, una deviazione standard comune del 10%, e un tasso di abbandono del 25%.
Sia i punti finali di efficacia che quelli di sicurezza sono stati analizzati con i dati di tutti i partecipanti assegnati casualmente (popolazione intenzione-di-trattare). Sono stati utilizzati due stimatori per valutare l’efficacia del trattamento da diverse prospettive e per tenere conto degli eventi intercorrenti in modo diverso: primo, lo stimatore del “regime di trattamento”, per il quale abbiamo utilizzato la strategia di politica del trattamento nell’addendum ICH E9 (Consiglio Internazionale per l’Armonizzazione dei Requisiti Tecnici per la Registrazione dei Farmaci per Uso Umano [ICH] Principi Statistici per Gli Studi Clinici [E9]) sugli stimatori e l’analisi di sensibilità negli studi clinici (R1), rappresentando l’effetto medio del trattamento del tirzepatide rispetto al placebo per tutti i partecipanti che avevano subito la randomizzazione, indipendentemente dalla discontinuità del trattamento, e secondo, lo stimatore dell'”efficacia”, rappresentando l’effetto medio del trattamento del tirzepatide rispetto al placebo per tutti i partecipanti che avevano subito la randomizzazione, se il trattamento fosse stato somministrato come previsto (secondo la strategia ipotetica nell’addendum ICH E9 [R1]).
I dettagli sugli stimatori, la gestione dei valori mancanti e i metodi di analisi statistica sono forniti nell’Appendice Supplementare. Tutti i risultati riportati sono per lo stimatore del regime di trattamento, a meno che non sia indicato diversamente. Il tasso di errore di tipo I è stato fortemente controllato all’interno di ciascuno stimatore indipendentemente per la valutazione dei punti finali coprimari e secondari chiave con un approccio grafico.
PARTICIPANTI
Demografia e caratteristiche cliniche dei partecipanti all’inizio del trial.
Il trial è stato condotto da dicembre 2019 ad aprile 2022 e ha incluso 2539 partecipanti (Tabella 1). Nel complesso, l’86,0% dei partecipanti ha completato il periodo di trattamento principale del trial (88,4% – 89,8% nei gruppi tirzepatide e 77,0% nel gruppo placebo) e l’81,9% ha aderito al trattamento o placebo come assegnato (83,5% – 85,7% nei gruppi tirzepatide e 73,6% nel gruppo placebo) (Fig. S2). Le interruzioni del trattamento dovute ad eventi avversi sono state del 4,3%, 7,1% e 6,2% con 5 mg, 10 mg e 15 mg di tirzepatide, rispettivamente, e 2,6% con placebo.
Le caratteristiche demografiche e cliniche di base erano generalmente simili tra i gruppi di trattamento (Tabella 1). L’età media dei partecipanti era di 44,9 anni; la maggior parte era di sesso femminile (67,5%) e bianca (70,6%); il peso corporeo medio era 104,8 kg, il BMI medio era 38,0 e la circonferenza media della vita era 114,1 cm; il 94,5% dei partecipanti aveva un BMI di 30 o superiore. I partecipanti hanno riferito una durata media dell’obesità di 14,4 anni; il 40,6% aveva prediabete all’inizio del trial, e quasi due terzi aveva una o più complicanze legate al peso (Tabella 1 e Tabella S1). I dati di arruolamento per paese, i dati demografici specifici per gli Stati Uniti e le informazioni sulla rappresentatività dei partecipanti al trial sono presentati nelle Tabelle S1, S2 e S3, rispettivamente.
CAMBIO DEL PESO CORPOREO
Punti finali secondari principali e ulteriori punti finali secondari per i gruppi di dosaggio di tirzepatide raggruppati (Estimand del regime di trattamento).
Per l’estimand del regime di trattamento, la variazione media del peso alla settimana 72 era del -15,0% (95% CI, -15,9 a -14,2) con una dose settimanale di 5 mg di tirzepatide, -19,5% (95% CI, -20,4 a -18,5) con una dose da 10 mg, e -20,9% (95% CI, -21,8 a -19,9) con una dose da 15 mg e -3,1% (95% CI, -4,3 a -1,9) con placebo (Figura 1A e Tabella 2). Tutte e tre le dosi di tirzepatide erano superiori al placebo
nella variazione del peso alla settimana 72 (differenza percentuale rispetto al placebo: -11,9 punti percentuali [pp]; 95% CI, -13,4 a -10,4; P <0,001 per 5 mg; -16,4 pp; 95% CI, -18,0 a -14,8; P <0,001 per 10 mg; -17,8 pp; 95% CI, -19,4 a -16,2; P <0,001 per 15 mg).
La proporzione di partecipanti che hanno raggiunto una riduzione del peso corporeo del 5% o più alla settimana 72 era significativamente maggiore con tutte e tre le dosi di tirzepatide rispetto al placebo (81,0% [95% CI, 76,8 a 84,8] per 5 mg; 92,1% [95% CI, 88,8 a 94,6] per 10 mg; 93,7% [95% CI, 90,8 a 95,9] per 15 mg vs 31,1% [95% CI, 26,1 a 36,5] per placebo) (Figura 1B e Tabella 2). Una proporzione significativamente maggiore di partecipanti nei gruppi di tirzepatide ha raggiunto una riduzione del peso corporeo del 10% o più e del 15% o più rispetto al placebo (Figura 1B e Tabella 2). Per l’estimand del regime di trattamento, una proporzione significativamente maggiore di partecipanti nei gruppi di tirzepatide ha raggiunto una riduzione del peso corporeo del 20% o più e del 25% o più rispetto al placebo (Figura 1B e Tabella 2).
I cambiamenti medi nel peso corporeo rispetto all’inizio del trial erano significativamente diversi con tutte e tre le dosi di tirzepatide rispetto al placebo in tutte le visite programmate a partire dalla settimana 4 (Figura S3). I cambiamenti medi nel peso corporeo rispetto all’inizio del trial al tempo dell’interruzione del trattamento erano simili a quelli osservati alla settimana 72 per tutti i gruppi di trattamento (Figura S4). I cambiamenti medi nel peso corporeo rispetto all’inizio del trial erano simili in tutti i sottogruppi di partecipanti, compresi quelli con e senza prediabete all’inizio del trial (Figura S5 e S6).
RISULTATI SULLA SALUTE CARDIOVASCOLARE
Per l’estimand del regime di trattamento, il cambiamento medio nella circonferenza della vita alla settimana 72 era di -13,7 cm (95% CI, -14,6 a -12,8) con una dose settimanale di 5 mg di tirzepatide, -16,4 cm (95% CI, -17,4 a -15,5) con una dose da 10 mg, e -17,2 cm (95% CI, -18,1 a -16,2) con una dose da 15 mg e -5,3 cm (95% CI, -6,7 a -4,0) con placebo (Figura
2A e Tabella 2). Tutte e tre le dosi di tirzepatide erano superiori al placebo nella variazione della circonferenza della vita alla settimana 72 (differenza rispetto al placebo: -8,4 cm; 95% CI, -9,8 a -7,0; P <0,001 per 5 mg; -11,1 cm; 95% CI, -12,6 a -9,6; P <0,001 per 10 mg; -11,9 cm; 95% CI, -13,4 a -10,4; P <0,001 per 15 mg).
References
- 1.World Obesity Federation. World obesity atlas 2022 (https://www.worldobesity.org/resources/resource-library/world-obesity-atlas-2022. opens in new tab).
- 2.Di Angelantonio E, Bhupathiraju ShN, Wormser D, et al. Body-mass index and all-cause mortality: individual-participant-data meta-analysis of 239 prospective studies in four continents. Lancet 2016;388:776-786.
- 3.Powell-Wiley TM, Poirier P, Burke LE, et al. Obesity and cardiovascular disease: a scientific statement from the American Heart Association. Circulation 2021;143(21):e984-e1010.
- 4.Dobbs R, Sawers C, Thompson F, et al. How the world could better fight obesity. McKinsey Global Institute, November 1, 2014 (https://www.mckinsey.com/industries/healthcare-systems-and-services/our-insights/how-the-world-could-better-fight-obesity. opens in new tab).
- 5.Aronne LJ, Hall KD, M Jakicic J, et al. Describing the weight-reduced state: physiology, behavior, and interventions. Obesity (Silver Spring) 2021;29:Suppl 1:S9-S24.
- 6.Schwartz MW, Seeley RJ, Zeltser LM, et al. Obesity pathogenesis: an endocrine society scientific statement. Endocr Rev 2017;38:267-296.
- 7.Apovian CM, Aronne LJ, Bessesen DH, et al. Pharmacological management of obesity: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2015;100:342-362.
- 8.Wharton S, Lau DCW, Vallis M, et al. Obesity in adults: a clinical practice guideline. CMAJ 2020;192(31):E875-E891.
- 9.Pi-Sunyer X, Astrup A, Fujioka K, et al. A randomized, controlled trial of 3.0 mg of liraglutide in weight management. N Engl J Med 2015;373:11-22.
- 10.Wilding JPH, Batterham RL, Calanna S, et al. Once-weekly semaglutide in adults with overweight or obesity. N Engl J Med 2021;384:989-1002
- 11.Samms RJ, Coghlan MP, Sloop KW. How may GIP enhance the therapeutic efficacy of GLP-1? Trends Endocrinol Metab 2020;31:410-421.
- 12.Coskun T, Sloop KW, Loghin C, et al. LY3298176, a novel dual GIP and GLP-1 receptor agonist for the treatment of type 2 diabetes mellitus: from discovery to clinical proof of concept. Mol Metab 2018;18:3-14.
- 13.American Diabetes Association. 2. Classification and diagnosis of diabetes: Standards of Medical Care in Diabetes-2019. Diabetes Care 2019;42:Suppl 1:S13-S28.
- 14.European Medicines Agency. ICH E9 (R1) addendum on estimands and sensitivity analysis in clinical trials to the guideline on statistical principles for clinical trials. February 17, 2020 (https://www.ema.europa.eu/en/documents/scientific-guideline/ich-e9-r1-addendum-estimands-sensitivity-analysis-clinical-trials-guideline-statistical-principles_en.pdf. opens in new tab).
- 15.Ryan DH, Yockey SR. Weight loss and improvement in comorbidity: differences at 5%, 10%, 15%, and over. Curr Obes Rep 2017;6:187-194.
- 16.Kolotkin RL, Andersen JR. A systematic review of reviews: exploring the relationship between obesity, weight loss and health-related quality of life. Clin Obes 2017;7:273-289.
- 17.Garvey WT, Mechanick JI, Brett EM, et al. American Association of Clinical Endocrinologists and American College of Endocrinology comprehensive clinical practice guidelines for medical care of patients with obesity. Endocr Pract 2016;22:Suppl 3:1-203.
- 18.American Diabetes Association. Obesity management for the treatment of type 2 diabetes: Standards of Medical Care in Diabetes-2020. Diabetes Care 2020;43:Suppl 1:S89-S97.
- 19.Aminian A, Al-Kurd A, Wilson R, et al. Association of Bariatric surgery with major adverse liver and cardiovascular outcomes in patients with biopsy-proven nonalcoholic steatohepatitis. JAMA 2021;326:2031-2042.
- 20.van Rijswijk AS, van Olst N, Schats W, van der Peet DL, van de Laar AW. What is weight loss after bariatric surgery expressed in percentage total weight loss (%TWL)? A systematic review. Obes Surg 2021;31:3833-3847.
- 21.Pownall HJ, Schwartz AV, Bray GA, et al. Changes in regional body composition over 8 years in a randomized lifestyle trial: the look AHEAD study. Obesity (Silver Spring) 2016;24:1899-1905.
- 22.Magkos F, Fraterrigo G, Yoshino J, et al. Effects of moderate and subsequent progressive weight loss on metabolic function and adipose tissue biology in humans with obesity. Cell Metab 2016;23:591-601.
- 23.Rosenstock J, Wysham C, Frías JP, et al. Efficacy and safety of a novel dual GIP and GLP-1 receptor agonist tirzepatide in patients with type 2 diabetes (SURPASS-1): a double-blind, randomised, phase 3 trial. Lancet 2021;398:143-155.
- 24.Frías JP, Davies MJ, Rosenstock J, et al. Tirzepatide versus semaglutide once weekly in patients with type 2 diabetes. N Engl J Med 2021;385:503-515.
- 25.Ludvik B, Giorgino F, Jódar E, et al. Once-weekly tirzepatide versus once-daily insulin degludec as add-on to metformin with or without SGLT2 inhibitors in patients with type 2 diabetes (SURPASS-3): a randomised, open-label, parallel-group, phase 3 trial. Lancet 2021;398:583-598.
- 26.Del Prato S, Kahn SE, Pavo I, et al. Tirzepatide versus insulin glargine in type 2 diabetes and increased cardiovascular risk (SURPASS-4): a randomised, open-label, parallel-group, multicentre, phase 3 trial. Lancet 2021;398:1811-1824.
- 27.Dahl D, Onishi Y, Norwood P, et al. Effect of Subcutaneous tirzepatide vs placebo added to titrated insulin glargine on glycemic control in patients with type 2 diabetes: the SURPASS-5 randomized clinical trial. JAMA 2022;327:534-545.
- 28.Davies M, Færch L, Jeppesen OK, et al. Semaglutide 2·4 mg once a week in adults with overweight or obesity, and type 2 diabetes (STEP 2): a randomised, double-blind, double-dummy, placebo-controlled, phase 3 trial. Lancet 2021;397:971-984.
- 29.Wadden TA, Bailey TS, Billings LK, et al. Effect of subcutaneous semaglutide vs placebo as an adjunct to intensive behavioral therapy on body weight in adults with overweight or obesity: the STEP 3 randomized clinical trial. JAMA 2021;325:1403-1413.
- 30.Rubino D, Abrahamsson N, Davies M, et al. Effect of continued weekly subcutaneous semaglutide vs placebo on weight loss maintenance in adults with overweight or obesity: the STEP 4 randomized clinical trial. JAMA 2021;325:1414-1425.
- 31.Anveden Å, Peltonen M, Näslund I, Torgerson J, Carlsson LMS. Long-term incidence of gallstone disease after bariatric surgery: results from the nonrandomized controlled Swedish Obese Subjects study. Surg Obes Relat Dis 2020;16:1474-1482.