⛔ In Italia ne è vietato l’uso e la prescrizione. L’articolo ha solo finalità informative
Benefici generali per la salute di Ipamorelin
- Costruisce la massa muscolare magra [1-28]
- Mantiene ossa sane [29-36]
- Migliora la salute dell’apparato digerente [37-46]
- Mantiene un cuore sano [47-61]
- Migliora i livelli di zucchero nel sangue [62-72]
- Rafforza il sistema immunitario [73-111]
- Previene il declino cognitivo [112-148]
- Migliora il desiderio sessuale e la funzione sessuale [149-183]
- Migliora la rigenerazione dei tessuti [182-203]
- Migliora la qualità del sonno [204-224]
Cos’è Ipamorelin?
Ipamorelin è considerato un peptide che rilascia l’ormone della crescita (GHRP) o secretagogo dell’ormone della crescita. Come pentapeptide (composto da cinque aminoacidi), ha la capacità di imitare il rilascio naturale del corpo dell’ormone della crescita e della grelina (l’ormone della fame). Poiché questo peptide non influenza il rilascio di altri ormoni nel corpo come acetilcolina, aldosterone, cortisolo e prolattina, non ha praticamente effetti collaterali negativi. Pertanto, è considerata una delle forme più sicure ed efficaci di terapia sostitutiva dell’ormone della crescita, ampiamente utilizzata per combattere gli effetti dell’invecchiamento, gestire alcune malattie, migliorare le prestazioni sportive e bilanciare la carenza di ormone della crescita. Inoltre, la maggior parte dei professionisti medici prescrive ipamorelin più di altre terapie perché può aiutare a ottimizzare l’ormone della crescita umano per un periodo di tempo più lungo,
Come funziona Ipamorelin?
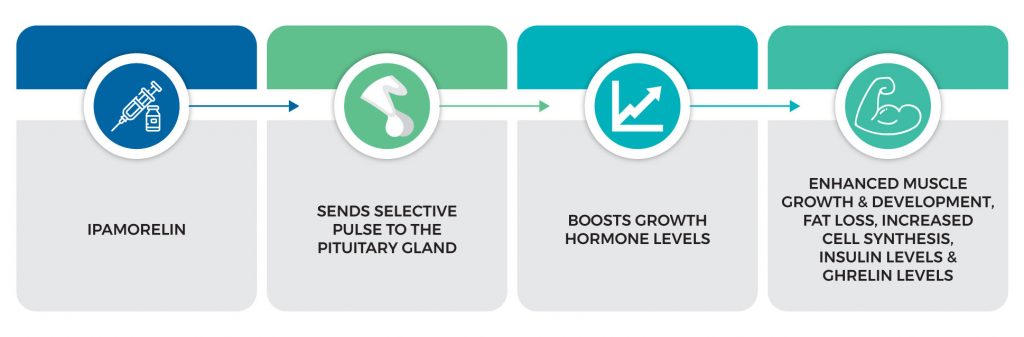
Dopo l’iniezione di ipamorelina, viene inviato un impulso selettivo alla ghiandola pituitaria, che a sua volta rilascia l’ormone della crescita all’interno del corpo. Ciò fa sì che le cellule si spostino verso i muscoli per sostenere la crescita e lo sviluppo, prevenendo al contempo qualsiasi deformità ossea o cartilaginea. Inoltre, l’ipamorelina aumenta la sintesi cellulare, i livelli di insulina e i livelli di grelina. Tutte queste funzioni vitali lavorano per promuovere la perdita di grasso e aumentare la massa muscolare e la forza.
Struttura chimica di Ipamorelin
Ricerca su Ipamorelin
Costruisce massa muscolare magra
Ottenere una percentuale più alta di massa muscolare magra riducendo il grasso corporeo è il motivo più evidente per cui culturisti, atleti e persino dilettanti optano per le iniezioni di ipamorelin. Gli studi dimostrano che ipamorelin ha potenti proprietà di costruzione muscolare che possono aiutare coloro che vogliono migliorare la loro composizione corporea:
- Gli studi dimostrano che l’ipamorelina aumenta i livelli dell’ormone della crescita (GH), un processo vitale per la crescita e lo sviluppo muscolare. [1-8]
- Aumentando i livelli di GH, ipamorelin aiuta a migliorare la sintesi muscolare. [1-17]
- In quanto peptide che rilascia l’ormone della crescita, l’ipamorelina promuove la crescita muscolare e inibisce l’atrofia muscolare. [18-19]
- In un paziente con anoressia nervosa gravemente emaciato, l’applicazione intranasale di un anno del peptide che rilascia l’ormone della crescita ha migliorato la massa muscolare e la forza. [20]
- Aumentando i livelli di grelina, ipamorelin migliora la massa muscolare aumentando l’assunzione di cibo. [21-23]
- La somministrazione di peptidi che rilasciano l’ormone della crescita aumenta la massa muscolare promuovendo la rigenerazione muscolare e aumentando i livelli di collagene. [24-27]
- Nei ratti, la somministrazione di ipamorelin ha contrastato l’atrofia muscolare indotta dalle iniezioni di glucocorticoidi. [28]
Mantiene le ossa sane
Oltre a raggiungere la massa muscolare magra, la somministrazione di ipamorelin può anche aiutare a mantenere una struttura scheletrica sana e prevenire vari disturbi ossei. Gli studi che valutano gli effetti benefici dell’ipamorelina sulla salute delle ossa hanno mostrato risultati positivi:
- Nei bambini con deficit di GH, la somministrazione di peptidi che rilasciano l’ormone della crescita come l’ipamorelina ha aumentato la velocità di crescita ossea. [29-33]
- Nei ratti, la somministrazione di ipamorelin ha indotto la crescita ossea longitudinale. [34]
- Nei ratti femmina adulti, la somministrazione di ipamorelin ha aumentato il contenuto minerale osseo senza effetti collaterali o tossicità. [35]
- Uno studio ha riportato che la capacità di ipamorelin di stimolare il rilascio dell’ormone della crescita può aiutare nella formazione e nella crescita ossea. [36]
Migliora la salute dell’apparato digerente
Ipamorelin svolge anche un ruolo fondamentale nel mantenimento della salute del sistema digestivo. Gli studi dimostrano che i peptidi che rilasciano l’ormone della crescita come l’ipamorelina aiutano a migliorare la funzione gastrointestinale:
- Il peptide che rilascia l’ormone della crescita migliora la salute dell’apparato digerente proteggendo da vari tipi di ulcere. [37]
- Nell’uomo, la somministrazione di ipamorelina migliora la motilità gastrica (contrazioni della muscolatura liscia gastrica) aumentando i livelli di grelina. [38]
- In un paziente con anoressia nervosa gravemente emaciato, l’applicazione intranasale di un anno del peptide che rilascia l’ormone della crescita ha migliorato la disfunzione del tratto digestivo, come evidenziato da un aumento dell’assunzione di cibo e del peso corporeo. [39]
- Nei pazienti sottoposti a chirurgia addominale maggiore, la somministrazione di ipamorelin ha migliorato la funzione del tratto gastrointestinale superiore e inferiore. [40]
- Nei ratti, la somministrazione di ipamorelina ha aumentato i livelli di grelina, che a sua volta ha migliorato la funzione gastrointestinale. [41-43]
- In un modello di roditore di ileo postoperatorio (malfunzionamento della motilità intestinale dopo chirurgia addominale), la somministrazione di ipamorelin ha accelerato lo svuotamento gastrico, il che suggerisce un miglioramento della funzione gastrointestinale. [44-45]
- Nei ratti, la somministrazione di ipamorelin ha aumentato la produzione di pellet fecale dopo un intervento chirurgico addominale. [46]
Mantiene un cuore sano
Recenti studi clinici sull’uomo e studi sugli animali mostrano che l’ipamorelina e altri peptidi che rilasciano l’ormone della crescita hanno effetti cardioprotettivi che possono aiutare a combattere varie malattie cardiache:
- Nei pazienti con malattie cardiache, la somministrazione del peptide che rilascia l’ormone della crescita ha migliorato la gittata cardiaca e il lavoro meccanico ventricolare. [47]
- Nei pazienti con malattia coronarica sottoposti a intervento chirurgico di bypass, la somministrazione del peptide di rilascio dell’ormone della crescita ha aumentato la frazione di eiezione ventricolare sinistra. [48]
- Nei soggetti umani, la somministrazione del peptide che rilascia l’ormone della crescita ha contribuito a proteggere dai danni cardiaci indotti dalla mancanza di ossigeno. [49]
- In volontari sani, la somministrazione endovenosa acuta del peptide che rilascia l’ormone della crescita ha indotto un chiaro e rapido aumento della frazione di eiezione ventricolare sinistra. [50-51]
- Nei pazienti con insufficienza cardiaca, la somministrazione di ipamorelin ha aumentato le contrazioni del muscolo cardiaco aumentando i livelli di IGF-1. [52-54]
- Nei ratti, la somministrazione del peptide che rilascia l’ormone della crescita ha protetto contro i danni cardiaci causati dalla mancanza di ossigeno. [55]
- Nei ratti sottoposti a infarto miocardico sperimentale, la somministrazione del peptide di rilascio dell’ormone della crescita ha aumentato il volume del sangue pompato dal ventricolo sinistro del cuore. [56]
- Nei ratti, la somministrazione del peptide che rilascia l’ormone della crescita ha aumentato la forza delle contrazioni muscolari del cuore. [57]
- Nei ratti, la somministrazione del peptide che rilascia l’ormone della crescita ha prevenuto l’insufficienza cardiaca proteggendo dai danni dei radicali. [58]
- Nei criceti con cardiomiopatia dilatativa, il trattamento di 4 settimane con l’ormone della crescita che rilascia il peptide ha attenuato la disfunzione e la dilatazione del ventricolo sinistro. [59]
- Nei cani con ridotto afflusso di sangue al cuore, la somministrazione del peptide che rilascia l’ormone della crescita ha prevenuto la morte aumentando lo spessore della parete cardiaca, il che è indicativo di una migliore circolazione sanguigna. [60]
- Nei suini, la somministrazione del peptide che rilascia l’ormone della crescita ha mostrato effetti antiossidanti, che a loro volta hanno ridotto il danno al muscolo cardiaco. [61]
Migliora i livelli di zucchero nel sangue
Ipamorelin ha anche potenti effetti ipoglicemizzanti che possono aiutare a prevenire il diabete e altre condizioni mediche fatali associate all’aumento cronico dei livelli di zucchero nel sangue. Forti prove scientifiche supportano questo effetto benefico:
- Nei pazienti diabetici, la somministrazione del peptide che rilascia l’ormone della crescita ha migliorato i livelli di zucchero nel sangue aumentando la secrezione di GH. [62]
- Aumentando i livelli di GH, ipamorelin può aiutare a ridurre il rischio di diabete. [63]
- Nei ratti diabetici, la somministrazione di ipamorelin ha stimolato il rilascio di insulina, un ormone che abbassa i livelli di zucchero nel sangue. [64-65]
- Nei ratti diabetici, la somministrazione di ipamorelin ha abbassato i livelli di zucchero nel sangue aumentando la produzione di IGF-1. [66]
- L’iniezione endovenosa dell’ormone della crescita umano che rilascia il peptide nei ratti ha aumentato i livelli ematici di insulina. [67]
- Nei ratti diabetici, il pretrattamento con il peptide di rilascio dell’ormone della crescita sintetico ha migliorato la secrezione di insulina e le riserve di insulina. [68-72]
Rafforza il sistema immunitario
Vi sono prove crescenti che l’ipamorelina può aiutare a potenziare la funzione immunitaria attraverso vari meccanismi importanti:
- La somministrazione di peptidi che rilasciano l’ormone della crescita può aiutare a migliorare la qualità della vita dei malati di cancro correggendo gli stati nutrizionali e metabolici. [73]
- Nei pazienti con deficit dell’ormone della crescita, l’aumento dei livelli di GH attraverso la somministrazione del peptide che rilascia l’ormone della crescita ha aumentato i livelli di globuli bianchi, cellule T e cellule B del sistema immunitario. [74-75]
- Nei ratti, la somministrazione di peptidi che rilasciano l’ormone della crescita come l’ipamorelina ha contrastato l’infiammazione attraverso la via attivata da AKT1 e ridotto la morte cellulare programmata (apoptosi) combattendo allo stesso tempo lo stress ossidativo. [76-77]
- Nei modelli animali, la somministrazione del peptide che rilascia l’ormone della crescita ha protetto contro la sclerosi multipla, i danni ai nervi e le malattie cerebrali. [78-81]
- Nei topi, la somministrazione di peptidi che rilasciano l’ormone della crescita ha migliorato i titoli anticorpali contro vari microrganismi nocivi. [82]
- Come peptide che rilascia l’ormone della crescita, ipamorelin aiuta a rafforzare il sistema immunitario aumentando i livelli di GH. [83-95]
- Come stimolante dell’ormone della crescita, l’ipamorelina migliora la funzione immunitaria stimolando la proliferazione delle cellule T e B e la sintesi delle immunoglobuline e favorendo la maturazione delle cellule staminali e la modulazione della risposta infiammatoria. [96]
- Aumentando i livelli di GH, ipamorelin migliora l’attività funzionale delle cellule circolanti dei fagociti (cellule che inghiottono corpi estranei). [97]
- Ipamorelin può anche migliorare l’attività citotossica mediata dalle cellule natural killer. [98-100]
- Aumentando i livelli di GH, ipamorelin può aumentare la produzione di varie cellule del sistema immunitario come IL-1β, TNF-α, IL-6 e citochine. [101-102]
- I secretagoghi dell’ormone della crescita come l’ipamorelina migliorano lo sviluppo del timo, una ghiandola che produce cellule T per il sistema immunitario. [103-110]
- La somministrazione di secretagoghi dell’ormone della crescita ha aumentato la resistenza del tumore nei topi. [111]
Previene il declino cognitivo
Ripristinando l’ormone della crescita a livelli sani, ipamorelin insieme ad altri peptidi che rilasciano l’ormone della crescita possono aiutare a prevenire il declino della funzione cognitiva correlato all’età e quelli causati da determinate condizioni mediche:
- Nei pazienti con deterioramento cognitivo, la somministrazione di secretagoghi dell’ormone della crescita come ipamorelin ha migliorato il declino correlato all’età della funzione cognitiva. [112]
- Negli anziani, la somministrazione di secretagoghi dell’ormone della crescita ha migliorato la memoria a breve termine e le capacità di problem solving attivo. [113]
- In uomini e donne anziani sani, la somministrazione di secretagoghi dell’ormone della crescita ha migliorato la funzione cognitiva. [114]
- Negli anziani sani, la somministrazione di secretagoghi dell’ormone della crescita ha prevenuto il declino cognitivo associato all’invecchiamento e al morbo di Alzheimer. [115]
- Negli adulti con decadimento cognitivo lieve e negli anziani con funzione cognitiva normale, la somministrazione di secretagoghi dell’ormone della crescita ha migliorato la funzione cognitiva aumentando i livelli di sostanze chimiche cerebrali come l’acido gamma-aminobutirrico e l’N-acetil-aspartil-glutammato. [116]
- Aumentando i livelli di grelina, ipamorelin aiuta a proteggere le cellule cerebrali dalla morte cellulare programmata, prevenendo così il declino cognitivo. [117-122]
- La somministrazione di Ipamorelin può aiutare a prevenire la malattia di Parkinson aumentando i livelli di grelina, che a sua volta previene la perdita di dopamina, una sostanza chimica del cervello che svolge un ruolo importante nel comportamento motivato dalla ricompensa. [123-130]
- La somministrazione di secretagoghi dell’ormone della crescita aumenta i livelli di IGF-1, che a sua volta attiva le vie intracellulari coinvolte nella protezione delle cellule nervose nel cervello. [131-148]
Migliora il desiderio sessuale e la funzione sessuale
In quanto peptide che rilascia l’ormone della crescita, l’ipamorelina può aumentare indirettamente la libido e migliorare la funzione sessuale aumentando i livelli di GH e IGF-1:
- Prove convincenti suggeriscono che la carenza di ormone della crescita è fortemente legata alla bassa libido e alla disfunzione erettile, suggerendo che l’aumento dei livelli di GH attraverso l’integrazione di ipamorelina può avere effetti benefici sulla libido. [149-156]
- Vi sono prove crescenti che la carenza di IGF-1 è fortemente legata alla bassa libido e alla disfunzione erettile, suggerendo che l’integrazione di ipamorelina può aiutare a migliorare il desiderio e la funzione sessuale. [157-163]
- Negli uomini di età avanzata, l’integrazione di peptidi che rilasciano l’ormone della crescita ha migliorato significativamente la libido e il benessere generale. [164]
- Aumentando i livelli di GH e IGF-1, ipamorelin migliora indirettamente la funzione sessuale aumentando i livelli di ossido nitrico, una molecola prodotta naturalmente nel corpo che stimola erezioni del pene più dure e più lunghe. [165-173]
- Oltre ai livelli di GH e IGF-1, la somministrazione di ipamorelin aumenta anche i livelli di testosterone ed estrogeni, necessari per la regolazione dei pensieri sessuali, del desiderio e della funzione sessuale. [174-175]
- Gli studi dimostrano che i peptidi che rilasciano l’ormone della crescita svolgono un ruolo fondamentale nell’erezione del pene e nell’eccitazione sessuale. [176-183]
Migliora la rigenerazione dei tessuti
I peptidi che rilasciano l’ormone della crescita come l’ipamorelina possono aiutare a riparare i tessuti danneggiati causati da un infortunio sportivo o da un trauma fisico. Esistono forti prove scientifiche a sostegno delle proprietà rigenerative dell’ipamorelina:
- Ipamorelin e altri peptidi possono essere un’opzione terapeutica per la riparazione e la rigenerazione della cartilagine. [184-185]
- I peptidi possono migliorare la rigenerazione dei tessuti migliorando la sintesi del collagene e fornendo supporto strutturale e biochimico alle cellule circostanti dell’area lesa. [186]
- I peptidi possono anche accelerare il processo di guarigione delle ferite aumentando la produzione di collagene. [187-189]
- I peptidi possono accelerare la guarigione di vari difetti della cartilagine. [190-193]
- Reclutando determinate cellule necessarie per la riparazione del tessuto danneggiato, i peptidi riducono i tempi di guarigione e migliorano il recupero dei tessuti. [194-195]
- I peptidi hanno la capacità di sostenere la struttura dei tessuti danneggiati consentendo loro di guarire. [196]
- I peptidi migliorano la rigenerazione dei tessuti promuovendo la condrogenesi, il processo mediante il quale si sviluppa la cartilagine. [197-200]
- Promuovendo l’adesione cellulare, l’ipamorelina e altri peptidi possono migliorare la riparazione del tessuto cartilagineo. [201-203]
Migliora la qualità del sonno
Ipamorelin e altri peptidi che rilasciano l’ormone della crescita svolgono un ruolo fondamentale nella promozione del sonno ristoratore. Gli studi dimostrano che aumentando i livelli di GH e IGF-1, oltre a migliorare alcuni processi del sonno, ipamorelin migliora significativamente la qualità e la quantità del sonno:
- Negli uomini normali, la somministrazione del peptide che rilascia l’ormone della crescita ha aumentato il sonno ad onde lente (SWS), che viene spesso definito sonno profondo. [204]
- Nei giovani uomini sani, le iniezioni endovenose di peptidi che rilasciano l’ormone della crescita durante il sonno hanno costantemente stimolato il sonno ad onde lente. [205]
- Nei giovani maschi normali, la somministrazione del peptide che rilascia l’ormone della crescita ha aumentato il sonno della fase 2. [206]
- Aumentando i livelli di GH, ipamorelin migliora significativamente la fase del sonno profondo. [207-212]
- Aumentando i livelli di IGF-1, ipamorelin favorisce il sonno profondo. [213-223]
- Nei ratti, la somministrazione del peptide che rilascia l’ormone della crescita ha attivato i neuroni regolatori del sonno nel cervello. [224]
Effetti collaterali associati di Ipamorelin
Gli effetti collaterali di Ipamorelin sono molto rari. Ci sono stati alcuni effetti collaterali associati all’uso di questo farmaco in cui il paziente ha avuto uno dei problemi elencati di seguito ad un certo punto mentre era in ipamorelin. Tuttavia, non è stato confermato che questi effetti collaterali siano associati al trattamento e potrebbero essere stati una coincidenza e non correlati all’uso di ipamorelin. Nonostante ciò, è stato elencato come effetto collaterale associato a ipamorelin anche se questi effetti collaterali associati sono molto rari.
Gli effetti collaterali associati a ipamorelin possono includere quanto segue:
- Cambiamenti di gusto
- Oppressione toracica
- Difficoltà a deglutire
- Sonnolenza
- Bocca asciutta
- Arrossamento della pelle
- Mal di testa
- Orticaria
- Iperattività
- Aumento della fame
- Nausea
- Vomito
- Aumento della prolattina
La molecola non è autorizzata in Italia e ne è al momento vietato l’uso e la prescrizione
Nelle nazioni dove ne è consentito l’uso e negli studi scientifici e studi clinici eseguiti, la dose ottimale di Ipamorelin è spesso segnalato come 1 mcg di Ipamorelin per 1 kg di peso corporeo, tre volte al giorno.
Dosaggio di Ipamorelin per utenti nuovi
Per i principianti, si consiglia di assumere Ipamorelin 1 volte al giorno al mattino dopo aver mangiato. Prendetelo alla stessa ora ogni giorno per assicurarvi di introdurlo nel vostro corpo a un livello costante. Questo massimizza i risultati e minimizza i potenziali effetti collaterali.
La dose iniziale standard è di circa 100 μg a 150 μg al giorno in una iniezione singola.
Provate a assumerlo nel primo ciclo di 8-12 settimane. Durante il primo ciclo, Ipamorelin HGH dovrebbe crescere organicamente in quanto promuove la produzione naturale di GH nel vostro corpo.
Il dosaggio regolare è una quantità da 200 a 300 microgrammi per dose e che possono essere iniettati in 2-3 dosi giornaliere per 8-12 settimane. A questo fa seguito un mese di riposo.
Più alta è la dose, più significativo è l’aumento della produzione dell’ormone della crescita, permettendo un maggiore aumento muscolare, perdita di grasso e un recupero più veloce dall’allenamento e dagli infortuni.
Dosaggio per perdita di peso
Per la perdita di peso e gli effetti anti-invecchiamento, si raccomanda di prendere una dose più bassa (ad esempio, da 150 µg a 200 µg una volta al giorno) così da ottenere un rilascio più naturale e stabile.
Dosaggio di Ipamorelin negli atleti di forza
Per gli atleti di forza e i culturisti che fanno attività fisica regolarmente, l’Ipamorelin è di solito preso due o tre volte al giorno ad una media di 200 μg a 300 μg per dose. Per ottenere i migliori risultati, una dose viene assunta circa 40 minuti prima dell’allenamento per garantire un aumento delle prestazioni durante l’esercizio fisico intenso.
Indipendentemente dalla frequenza e dalla forza delle dosi, si consiglia agli utenti di aspettare almeno 3 ore tra l’assunzione di più dosi al giorno.
References
- Raun K, Hansen BS, Johansen NL, et al. Ipamorelin, the first selective growth hormone secretagogue. Eur J Endocrinol. 1998;139(5):552-61.
- Jiménez-reina L, Cañete R, De la torre MJ, Bernal G. Influence of chronic treatment with the growth hormone secretagogue Ipamorelin, in young female rats: somatotroph response in vitro. Histol Histopathol. 2002;17(3):707-14.
- Gobburu JV, Agersø H, Jusko WJ, Ynddal L. Pharmacokinetic-pharmacodynamic modeling of ipamorelin, a growth hormone releasing peptide, in human volunteers. Pharm Res. 1999;16(9):1412-6.
- Thomas A, Delahaut P, Krug O, Schänzer W, Thevis M. Metabolism of growth hormone releasing peptides. Anal Chem. 2012;84(23):10252-9.
- Johansen PB, Hansen KT, Andersen JV, Johansen NL. Pharmacokinetic evaluation of ipamorelin and other peptidyl growth hormone secretagogues with emphasis on nasal absorption. Xenobiotica. 1998;28(11):1083-92.
- Semenistaya E, Zvereva I, Thomas A, Thevis M, Krotov G, Rodchenkov G. Determination of growth hormone releasing peptides metabolites in human urine after nasal administration of GHRP-1, GHRP-2, GHRP-6, Hexarelin, and Ipamorelin. Drug Test Anal. 2015;7(10):919-25.
- Semenistaya E, Zvereva I, Thomas A, Thevis M, Krotov G, Rodchenkov G. Determination of growth hormone releasing peptides metabolites in human urine after nasal administration of GHRP-1, GHRP-2, GHRP-6, Hexarelin, and Ipamorelin. Drug Test Anal. 2015;7(10):919-25.
- Hansen TK, Ankersen M, Raun K, Hansen BS. Highly potent growth hormone secretagogues: hybrids of NN703 and ipamorelin. Bioorg Med Chem Lett. 2001 Jul 23;11(14):1915-8.
- Velloso CP. Regulation of muscle mass by growth hormone and IGF-I. British Journal of Pharmacology. 2008;154(3):557-568. doi:10.1038/bjp.2008.153.
- Tavares ABW, Micmacher E, Biesek S, et al. Effects of Growth Hormone Administration on Muscle Strength in Men over 50 Years Old. International Journal of Endocrinology. 2013;2013:942030. doi:10.1155/2013/942030.
- Devesa J, Almengló C, Devesa P. Multiple Effects of Growth Hormone in the Body: Is it Really the Hormone for Growth? Clinical Medicine Insights Endocrinology and Diabetes. 2016;9:47-71. doi:10.4137/CMED.S38201.
- Taaffe DR, Pruitt L, Reim J, et al. Effect of recombinant human growth hormone on the muscle strength response to resistance exercise in elderly men. J Clin Endocrinol Metab. 1994;79(5):1361-6.
- Weber MM. Effects of growth hormone on skeletal muscle. Horm Res. 2002;58 Suppl 3:43-8.
- Welle S, Thornton C, Statt M, Mchenry B. Growth hormone increases muscle mass and strength but does not rejuvenate myofibrillar protein synthesis in healthy subjects over 60 years old. J Clin Endocrinol Metab. 1996;81(9):3239-43.
- Sotiropoulos A, Ohanna M, Kedzia C, et al. Growth hormone promotes skeletal muscle cell fusion independent of insulin-like growth factor 1 up-regulation. Proceedings of the National Academy of Sciences of the United States of America. 2006;103(19):7315-7320. doi:10.1073/pnas.0510033103.
- Gonzalez S, Sathyapalan T, Javed Z, Atkin SL. Effects of Growth Hormone Replacement on Peripheral Muscle and Exercise Capacity in Severe Growth Hormone Deficiency. Front Endocrinol (Lausanne). 2018;9:56.
- Peroni CN, Hayashida CY, Nascimento N, et al. Growth hormone response to growth hormone-releasing peptide-2 in growth hormone-deficient Little mice. Clinics. 2012;67(3):265-272. doi:10.6061/clinics/2012(03)11.
- Berlanga-Acosta J, Abreu-Cruz A, Barco Herrera DG, et al. Synthetic Growth Hormone-Releasing Peptides (GHRPs): A Historical Appraisal of the Evidences Supporting Their Cytoprotective Effects. Clinical Medicine Insights Cardiology. 2017;11:1179546817694558. doi:10.1177/1179546817694558.
- Lim CJ, Jeon JE, Jeong SK, et al. Growth hormone-releasing peptide-biotin conjugate stimulates myocytes differentiation through insulin-like growth factor-1 and collagen type I. BMB Reports. 2015;48(9):501-506. doi:10.5483/BMBRep.2015.48.9.258.
- Haruta I, Fuku Y, Kinoshita K, et al. One-year intranasal application of growth hormone releasing peptide-2 improves body weight and hypoglycemia in a severely emaciated anorexia nervosa patient. Journal of Cachexia, Sarcopenia and Muscle. 2015;6(3):237-241. doi:10.1002/jcsm.12028.
- Inui A. Ghrelin: an orexigenic and somatotrophic signal from the stomach. Nat Rev Neurosci. 2001;2:551–560.
- Chen CY, Asakawa A, Fujimiya M, Lee SD, Inui A. Ghrelin gene products and the regulation of food intake and gut motility. Pharmacol Rev. 2009;61:430–481.
- Laferrère B, Abraham C, Russell CD, Bowers CY. Growth Hormone Releasing Peptide -2 (GHRP-2), like ghrelin, increases food intake in healthy men. The Journal of clinical endocrinology and metabolism. 2005;90(2):611-614. doi:10.1210/jc.2004-1719.
- Zhou S, Salisbury J, Preedy VR, Emery PW. Increased collagen synthesis rate during wound healing in muscle. PLoS One. (2013);8:e58324. doi: 10.1371/journal.pone.0058324.
- Bonaldo P, Braghetta P, Zanetti M, Piccolo S, Volpin D, Bressan GM. Collagen VI deficiency induces early onset myopathy in the mouse: an animal model for Bethlem myopathy. Hum Mol Genet. (1998);7:2135–2140. doi: 10.1093/hmg/7.13.2135.
- Takano H, Komuro I, Oka T, et al. The Rho family G proteins play a critical role in muscle differentiation. Mol Cell Biol. (1998);18:1580–1589. doi: 10.1128/MCB.18.3.1580.
- Schwander M, Leu M, Stumm M, et al. Beta1 integrins regulate myoblast fusion and sarcomere assembly. Dev Cell. (2003);4:673–685. doi: 10.1016/S1534-5807(03)00118-7.
- Andersen NB, Malmlöf K, Johansen PB, Andreassen TT, Ørtoft G, Oxlund H. The growth hormone secretagogue ipamorelin counteracts glucocorticoid-induced decrease in bone formation of adult rats. Growth Horm IGF Res. 2001;11(5):266-72.
- Mericq V, Cassorla F, Salazar T, et al. Effects of eight months treatment with graded doses of a growth hormone (GH)-releasing peptide in GH-deficient children. J Clin Endocrinol Metab. 1998;83(7):2355-60.
- Bellone J, Ghizzoni L, Aimaretti G, et al. Growth hormone-releasing effect of oral growth hormone-releasing peptide 6 (GHRP-6) administration in children with short stature. Eur J Endocrinol. 1995;133(4):425-9.
- Ghigo E, Arvat E, Muccioli G, Camanni F. Growth hormone-releasing peptides. Eur J Endocrinol. 1997;136(5):445-60.
- Mericq V, Cassorla F, Bowers CY, Avila A, Gonen B, Merriam GR. Changes in appetite and body weight in response to long-term oral administration of the ghrelin agonist GHRP-2 in growth hormone deficient children. J Pediatr Endocrinol Metab. 2003;16:981–985.
- Pihoker C, Kearns GL, French D, Bowers CY. Pharmacokinetics and pharmacodynamics of growth hormone-releasing peptide-2: a phase I study in children. J Clin Endocrinol Metab. 1998;83(4):1168–1172.
- Johansen PB, Nowak J, Skjaerbaek C, et al. Ipamorelin, a new growth-hormone-releasing peptide, induces longitudinal bone growth in rats. Growth Horm IGF Res. 1999;9(2):106-13.
- Svensson J, Lall S, Dickson SL, et al. The GH secretagogues ipamorelin and GH-releasing peptide-6 increase bone mineral content in adult female rats. J Endocrinol. 2000;165(3):569-77.
- Svensson, J., Lall, S., Dickson, S. L., Bengtsson, B. A., Rømer, J., Ahnfelt-Rønne, I., Ohlsson, C., & Jansson, J. O. (2001). Effects of growth hormone and its secretagogues on bone. Endocrine, 14(1), 63–66. https://doi.org/10.1385/ENDO:14:1:063.
- Guo S, Gao Q, Jiao Q, Hao W, Gao X, Cao JM. Gastric mucosal damage in water immersion stress: mechanism and prevention with GHRP-6. World J Gastroenterol. 2012;18(24):3145–3155.
- Tack J, Depoortere I, Bisschops R, et al. Influence of ghrelin on interdigestive gastrointestinal motility in humans. Gut. 2006;55(3):327-33.
- Haruta I, Fuku Y, Kinoshita K, et al. One-year intranasal application of growth hormone releasing peptide-2 improves body weight and hypoglycemia in a severely emaciated anorexia nervosa patient. Journal of Cachexia, Sarcopenia and Muscle. 2015;6(3):237-241. doi:10.1002/jcsm.12028.
- Beck DE, Sweeney WB, Mccarter MD. Prospective, randomized, controlled, proof-of-concept study of the Ghrelin mimetic ipamorelin for the management of postoperative ileus in bowel resection patients. Int J Colorectal Dis. 2014;29(12):1527-34.
- Depoortere I, De Winter B, Thijs T, De Man J, Pelckmans P, Peeters T. Comparison of the gastroprokinetic effects of ghrelin, GHRP-6 and motilin in rats in vivo and in vitro. Eur J Pharmacol. 2005;515(1–3):160–168.
- Kitazawa T, De Smet B, Verbeke K, Depoortere I, Peeters TL. Gastric motor effects of peptide and non-peptide ghrelin agonists in mice in vivo and in vitro. Gut. 2005;54(8):1078–1084.
- Xu L, Depoortere I, Tomasetto C, et al. Evidence for the presence of motilin, ghrelin, and the motilin and ghrelin receptor in neurons of the myenteric plexus. Regul Pept. 2005;124(1–3):119–125.
- Greenwood-Van Meerveld B, Tyler K, Mohammadi E, Pietra C. Efficacy of ipamorelin, a ghrelin mimetic, on gastric dysmotility in a rodent model of postoperative ileus. Journal of Experimental Pharmacology. 2012;4:149-155. doi:10.2147/JEP.S35396.
- Qiu WC, Wang ZG, Wang WG, Yan J, Zheng Q. Gastric motor effects of ghrelin and growth hormone releasing peptide 6 in diabetic mice with gastroparesis. World J Gastroenterol. 2008;14(9):1419-24.
- Venkova K, Mann W, Nelson R, Greenwood-Van Meerveld B. Efficacy of ipamorelin, a novel ghrelin mimetic, in a rodent model of postoperative ileus. J Pharmacol Exp Ther. 2009;329(3):1110–1116.
- Fazio S. Sabatini D. Capaldo B. et al. A preliminary study of growth hormone in the treatment of dilated cardiomyopathy N. Engl. J. Med. 1996 334 809 814.
- Broglio F. Guarracino F. Benso A. et al. Effects of acute hexarelin administration on cardiac performance in patients with coronary artery disease during by-pass surgery Eur. J. Pharmacol. 2002 448 193 200.
- Bisi G, Podio V, Valetto MR, Broglio F, Bertuccio G, Del Rio G, Arvat E, Boghen MF, Deghengi R, Muccioli G, Ong H, Ghigo E 1999 Acute cardiovascular and hormonal effects of GH and hexarelin, a synthetic GH-releasing peptide, in humans. J Endocrinol Invest 22:266–272.
- Bisi G, Podio V, Valetto MR, et al. Acute cardiovascular and hormonal effects of GH and hexarelin, a synthetic GH–releasing peptide, in humans. J Endocrinol Invest 1999 ; 224 : 266-72.
- Valetto MR, Podio V, Broglio F et al. The acute administration of Hexarelin, a peptidyl GH secretagogues, has GH-independent, positive inotropic effect in humans. In : Hormones and the Heart, Naples, Italy 1998 ; abs. p. 54.
- Ghigo E, Arvat E, Gianotti L et al. Growth hormone-releasing activity of Hexarelin, a new synthetic hexapeptide, after intravenous, subcutaneous, intranasal and oral administration in man. J Clin Endocrinol Metab 1994 ; 78 : 693-8.
- Rahim A, O’Neill PA, Shalet SM. Growth hormone status -during long-term hexarelin therapy. J Clin Endocrinol Metab 1998 ; 83 : 1644-9.
- Vasan RS, Sullivan LM, D’agostino RB, et al. Serum insulin-like growth factor I and risk for heart failure in elderly individuals without a previous myocardial infarction: the Framingham Heart Study. Ann Intern Med. 2003;139(8):642-8.
- Locatelli V. Rossoni G. Schweiger F. et al. Growth hormone independent cardioprotective effects of hexarelin in the rat Endocrinology 1999 140 4024 4031.
- Tivesten A. Bollano E. Caidahl K. et al. The growth hormone secretagogue hexarelin improves cardiac function in rats after experimental myocardial infarction Endocrinology 2000 141 60 66.
- Xu X.B. Cao J.M. Pang J.J. et al. The positive inotropic and calcium-mobilizing effects of growth hormone-releasing peptides on rat heart Endocrinology 2003 144 5050 5057.
- Titterington JS, Sukhanov S, Higashi Y, Vaughn C, Bowers C, Delafontaine P. Growth Hormone-Releasing Peptide-2 Suppresses Vascular Oxidative Stress in ApoE−/− Mice But Does Not Reduce Atherosclerosis. Endocrinology. 2009;150(12):5478-5487. doi:10.1210/en.2009-0283.
- Iwase M. Kanazawa H. Kato Y. et al. Growth-hormone releasing peptide can improve left ventricular dysfunction and attenuate dilation in dilated cardiomyopathic hamsters Cardiovasc. Res. 2004 61 30 38.
- Shen Y.T. Lynch J.J. Hargreaves R.J. Gould R.J. A growth hormone secretagogue prevents ischemic-induced mortality independently of the growth hormone pathway in dogs with chronic dilated cardiomyopathy J. Pharmacol. Exp. Ther. 2003 306 815 820.
- Berlanga J, Cibrian D, Guevara L, et al. Growth-hormone-releasing peptide 6 (GHRP6) prevents oxidant cytotoxicity and reduces myocardial necrosis in a model of acute myocardial infarction. Clin Sci. 2007;112(4):241-50.
- Catalina PF, Mallo F, Andrade MA, García-mayor RV, Diéguez C. Growth hormone (GH) response to GH-releasing peptide-6 in type 1 diabetic patients with exaggerated GH-releasing hormone-stimulated GH secretion. J Clin Endocrinol Metab. 1998;83(10):3663-7.
- Villares R, Kakabadse D, Juarranz Y, Gomariz RP, Martínez-a C, Mellado M. Growth hormone prevents the development of autoimmune diabetes. Proc Natl Acad Sci USA. 2013;110(48):E4619-27.
- Adeghate E, Ponery AS. Mechanism of ipamorelin-evoked insulin release from the pancreas of normal and diabetic rats. Neuro Endocrinol Lett. 2004;25(6):403-6.
- Granado M, García-cáceres C, Tuda M, Frago LM, Chowen JA, Argente J. Insulin and growth hormone-releasing peptide-6 (GHRP-6) have differential beneficial effects on cell turnover in the pituitary, hypothalamus and cerebellum of streptozotocin (STZ)-induced diabetic rats. Mol Cell Endocrinol. 2011;337(1-2):101-13.
- Johansen PB, Segev Y, Landau D, Phillip M, Flyvbjerg A. Growth hormone (GH) hypersecretion and GH receptor resistance in streptozotocin diabetic mice in response to a GH secretagogue. Exp Diabesity Res. 2003;4(2):73-81.
- Bailey CJ, Wilkes LC, Flatt PR, Conlon JM, Buchanan KD. Effects of growth hormone-releasing hormone on the secretion of islet hormones and on glucose homeostasis in lean and genetically obese-diabetic (ob/ob) mice and normal rats. J Endocrinol (1989) 123(1):19–24.10.1677/joe.0.1230019.
- Ludwig B, Ziegler CG, Schally AV, Richter C, Steffen A, Jabs N, et al. Agonist of growth hormone-releasing hormone as a potential effector for survival and proliferation of pancreatic islets. Proc Natl Acad Sci U S A (2010) 107(28):12623–8.10.1073/pnas.1005098107.
- Ludwig B, Rotem A, Schmid J, Weir GC, Colton CK, Brendel MD, et al. Improvement of islet function in a bioartificial pancreas by enhanced oxygen supply and growth hormone releasing hormone agonist. Proc Natl Acad Sci U S A (2012) 109(13):5022–7.10.1073/pnas.1201868109.
- Zhang X, Cui T, He J, Wang H, Cai R, Popovics P, et al. Beneficial effects of growth hormone-releasing hormone agonists on rat INS-1 cells and on streptozotocin-induced NOD/SCID mice. Proc Natl Acad Sci U S A (2015) 112(44):13651–6.10.1073/pnas.1518540112.
- Schubert U, Schmid J, Lehmann S, Zhang XY, Morawietz H, Block NL, et al. Transplantation of pancreatic islets to adrenal gland is promoted by agonists of growth-hormone-releasing hormone. Proc Natl Acad Sci U S A (2013) 110(6):2288–93.10.1073/pnas.1221505110.
- Schmid J, Ludwig B, Schally AV, Steffen A, Ziegler CG, Block NL, et al. Modulation of pancreatic islets-stress axis by hypothalamic releasing hormones and 11beta-hydroxysteroid dehydrogenase. Proc Natl Acad Sci U S A (2011) 108(33):13722–7.10.1073/pnas.1110965108.
- Perboni S, Bowers C, Kojima S, Asakawa A, Inui A. Growth hormone releasing peptide 2 reverses anorexia associated with chemotherapy with 5-fluoruracil in colon cancer cell-bearing mice. World J Gastroenterol. 2008;14(41):6303–6305.
- Abbassi V, Bellanti Humoral a cell-mediated immunity in growth hormone-deficient children: effect of therapy with human growth hormone. Pediat Res 1985; 19: 299-301.
- Rapaport R, Oleske J, Aldich H, Salomon S, Delfaus C, Denny T. Suppression of immune function in growth hormone-deficient children during treatment with human growth hormone. J Pediatr 1986; 109; 434-439.
- Granado M, Priego T, Martin AI, Villanua MA, Lopez-Calderon A. Anti-inflammatory effect of the ghrelin agonist growth hormone-releasing peptide-2 (GHRP-2) in arthritic rats. Am J Physiol Endocrinol Metab. 2005;288(3):E486-E492.
- Cao Y, Tang J, Yang T, et al. Cardioprotective effect of ghrelin in cardiopulmonary bypass involves a reduction in inflammatory response. PLoS One. 2013;8(1):e55021.
- García Del Barco D, Montero E, Coro-Antich RM, et al. Coadministration of epidermal growth factor and growth hormone releasing peptide-6 improves clinical recovery in experimental autoimmune encephalitis. Restor Neurol Neurosci. 2011;29(4):243–252.
- García Del Barco D, Perez-Saad H, Rodriguez V, et al. Therapeutic effect of the combined use of growth hormone releasing peptide-6 and epidermal growth factor in an axonopathy model. Neurotox Res. 2011;19(1):195–209.
- Garcia Del Barco-Herrera D, Martinez NS, Coro-Antich RM, et al. Epidermal growth factor and growth hormone-releasing peptide-6: combined therapeutic approach in experimental stroke. Restor Neurol Neurosci. 2013;31(2):213–223.
- Subiros N, Perez-Saad HM, Berlanga JA, et al. Assessment of dose-effect and therapeutic time window in preclinical studies of rhEGF and GHRP-6 coadministration for stroke therapy. Neurol Res. 2015;38(3):187–195.
- Martínez R, Hernández L, Gil L, et al. Growth hormone releasing peptide-6 enhanced antibody titers against subunit antigens in mice (BALB/c), tilapia (Oreochromis niloticus) and African catfish (Clarias gariepinus). Vaccine. 2017;35(42):5722-5728.
- Corpas E, Harman SM, Blackman MR. Human growth hormone and human aging. Endocrin Rev. 1993;14:20–39.
- Sonntag WE, Meites J. Decline in GH secretion in aging animals and man. In: Everett AV, Walton JR, editors. Regulation of neuroendocrine aging. Karger; Basel: 1988. pp. 111–124.
- Uberti ECD, Ambrosio MR, Cella SG, Margutti AR, Trasforini G, Rigamonti AE, Petrone E, Muller EE. Defective hypothalamic growth hormone (GH)-releasing hormone activity may contribute to declining GH secretion with age in man. J Clin Endocinol Metab. 1997;82:2885–2888.
- Russell-Aulet M, Jaffe CA, Demott-Friberg R, Barkan AL. In vivo semiquantification of hypothalamic growth hormone-releasing hormone (GHRH) output in humans: Evidence for relative GHRH deficiency in aging. J Clin Endocinol Metab. 1999;84:3490–3497.
- Gala RR. Prolactin and growth hormone in the regulation of the immune system. Proc Soc Exp Biol Med. 1991;198(1):513-27.
- Gelato MC. Growth hormone-insulinlike growth factor I and immune function. Trends Endocrinol Metab. 1993;4(3):106-10.
- Available at https://clinicaltrials.gov/ct2/show/NCT00663611.
- Takagi K, Suzuki F, Barrow RE, Wolf SE, Kobayashi M, Herndon DN. Growth hormone improves immune function and survival in burned mice infected with herpes simplex virus type 1. J Surg Res. 1997;69(1):166-70.
- Gelato MC. Aging and immune function: a possible role for growth hormone. Horm Res. 1996;45(1-2):46-9.
- Rapaport R, Oleske J, Ahdieh H, Solomon S, Delfaus C, Denny T. Suppression of immune function in growth hormone-deficient children during treatment with human growth hormone. J Pediatr. 1986;109(3):434-9.
- Meazza C, Pagani S, Travaglino P, Bozzola M. Effect of growth hormone (GH) on the immune system. Pediatr Endocrinol Rev. 2004;1 Suppl 3:490-5.
- Manfredi R, Tumietto F, Azzaroli L, Zucchini A, Chiodo F, Manfredi G. Growth hormone (GH) and the immune system: impaired phagocytic function in children with idiopathic GH deficiency is corrected by treatment with biosynthetic GH. J Pediatr Endocrinol. 1994;7(3):245-51.
- Tesselaar K, Miedema F. Growth hormone resurrects adult human thymus during HIV-1 infection. J Clin Invest. 2008;118(3):844-7.
- Meazza C, Pagani S, Travaglino P, Bozzola M. Effect of growth hormone (GH) on the immune system. Pediatr Endocrinol Rev. 2004;1 Suppl 3:490-5.
- Meazza C, Pagani S, Travaglino P, Bozzola M. Effect of growth hormone (GH) on the immune system. Pediatr Endocrinol Rev. 2004;1 Suppl 3:490-5.
- Saxena GB, Saxena RK, Adler WH. Regulation of natural killer activity in vivo. III. Effect of hypophysectomy and growth hormone treatment on the natural killer activity of the mouse spleen cell population. Int Arch Allergy Appl Immunol 1982; 67: 169-174.
- Kiess W, Malozowski S, Gelato M, Butenandt O, Doerr H, Crisp B, Eisl E, Maluish A, Belohradsky Lymphocyte subset distribution and natural killer activity in growth hormone deficiency before and during short-term treatment with growth hormone releasing hormone. Clin Immunol Immunopathol 1988; 48: 85-94.
- Bozzola M, De Amici M, Zecca M, Schimpff Rapaport M. Modulating effect of growth hormone on tumor necrosis factor-α and interleukin-1β. Eur J Endocrinol 1998; 139: 640-643.
- Bozzola M, De Benedetti F, De Amici M, Jouret B, Travaglino P, Pagani S, Conte F & Tauber Stimulating effect of growth hormone on cytokine release in children. Eur J Endocrinol 2003; 149: 1-5.
- Serri O, St-Jacques P, Sartippour M, Renier G. Alterations of monocyte function in patients with growth hormone deficiency: effect of substitutive GH therapy. J Clin Endocrinol Metab 1999; 84: 58-63.
- Kelley, K. W.. 1991. Growth hormone in immunobiology. R. Ader, and D. L. Felton, and N. Cohen, eds. Psychoneuroimmunology 2nd Ed.377 Academic Press, New York.
- Murphy, W. J., R. Hallgeir, D. L. Longo. 1995. Effects of growth hormone and prolactin in immune development and function. Life Sci. 57: 1.
- Clark, R.. 1997. The somatogenic hormones and insulin-like growth factor-1: stimulators of lymphopoiesis and immune function. Endocr. Rev. 18: 157.
- Smith, P. E.. 1930. Effect of hypophysectomy upon the involution of the thymus in the rat. Anat. Rec. 47: 119.
- Duquesnoy, R. J., G. M. Pederson. 1981. Immunology and hematologic deficiencies of the hipopituitary dwarf mouse. M. E. Gershwin, and B. Merchant, eds. In Immunology Defects in Laboratory Animals Vol. 1: 309 Plenum, New York.
- Gala, R. R., E. M. Shevach. 1993. Influence of prolactin and growth hormone on the activation of dwarf mouse lymphocytes in vivo. Proc. Soc. Exp. Biol. Med. 204: 224.
- Murphy, W. J., S. K. Durum, D. L Longo. 1992. Human growth hormone promotes engraftment of murine or human T cells in severe combined immunodeficient mice. Proc. Natl. Acad. Sci. USA 89: 4481.
- Taub, D. D., G. Tsarfaty, A. R. Lloyd, S. K. Durum, D. L. Longo, W. J. Murphy. 1994. Growth hormone promotes human T cells adhesion and migration to both human and murine matrix proteins in vitro and directly promotes xenogeneic engraftment. J. Clin. Inv. 94: 293.
- Koo GC, Huang C, Camacho R, et al. Immune enhancing effect of a growth hormone secretagogue. J Immunol. 2001;166(6):4195-201.
- Hersch EC, Merriam GR. Growth hormone (GH)–releasing hormone and GH secretagogues in normal aging: Fountain of Youth or Pool of Tantalus? Clinical Interventions in Aging. 2008;3(1):121-129.
- Aleman A, Verhaar HJ, De haan EH, et al. Insulin-like growth factor-I and cognitive function in healthy older men. J Clin Endocrinol Metab. 1999;84(2):471-5.
- Vitiello MV, Schwartz RS, Buchner KE, et al. Treating age-related changes in somatotrophic hormones, sleep, and cognition. Dialogs in Clinical Neuroscience. 2001;3:229–36.
- Vitiello MV, Moe KE, Merriam GR, Mazzoni G, Buchner DH, Schwartz RS. Growth hormone releasing hormone improves the cognition of healthy older adults. Neurobiol Aging. 2006;27(2):318-23.
- Friedman SD, Baker LD, Borson S, et al. Growth hormone-releasing hormone effects on brain γ-aminobutyric acid levels in mild cognitive impairment and healthy aging. JAMA Neurol. 2013;70(7):883-90.
- Kim SW, Her SJ, Park SJ, et al. Ghrelin stimulates proliferation and differentiation and inhibits apoptosis in osteoblastic MC3T3-E1 cells. Bone. 2005;37(3):359-69.
- Kim YS, Choi DH, Block ML, et al. A pivotal role of matrix metalloproteinase-3 activity in dopaminergic neuronal degeneration via microglial activation. FASEB J. 2007;21(1):179-87.
- Banks WA, Tschöp M, Robinson SM, Heiman ML. Extent and direction of ghrelin transport across the blood-brain barrier is determined by its unique primary structure. J Pharmacol Exp Ther. 2002;302(2):822-7.
- Chung H, Seo S, Moon M, Park S. Phosphatidylinositol-3-kinase/Akt/glycogen synthase kinase-3 beta and ERK1/2 pathways mediate protective effects of acylated and unacylated ghrelin against oxygen-glucose deprivation-induced apoptosis in primary rat cortical neuronal cells. J Endocrinol. 2008;198(3):511-21.
- García-cáceres C, Lechuga-sancho A, Argente J, Frago LM, Chowen JA. Death of hypothalamic astrocytes in poorly controlled diabetic rats is associated with nuclear translocation of apoptosis inducing factor. J Neuroendocrinol. 2008;20(12):1348-60.
- Frago LM, Pañeda C, Dickson SL, Hewson AK, Argente J, Chowen JA. Growth hormone (GH) and GH-releasing peptide-6 increase brain insulin-like growth factor-I expression and activate intracellular signaling pathways involved in neuroprotection. Endocrinology. 2002;143(10):4113-22.
- Zhang Y, Bhavnani BR. Glutamate-induced apoptosis in neuronal cells is mediated via caspase-dependent and independent mechanisms involving calpain and caspase-3 proteases as well as apoptosis inducing factor (AIF) and this process is inhibited by equine estrogens. BMC Neurosci. 2006;7:49.
- Halem HA, Taylor JE, Dong JZ, et al. A novel growth hormone secretagogue-1a receptor antagonist that blocks ghrelin-induced growth hormone secretion but induces increased body weight gain. Neuroendocrinology. 2005;81(5):339-49.
- Zigman JM, Nakano Y, Coppari R, et al. Mice lacking ghrelin receptors resist the development of diet-induced obesity. J Clin Invest. 2005;115(12):3564-72.
- Arnoult D, Karbowski M, Youle RJ. Caspase inhibition prevents the mitochondrial release of apoptosis-inducing factor. Cell Death Differ. 2003;10(7):845-9.
- Rungger-brändle E, Dosso AA, Leuenberger PM. Glial reactivity, an early feature of diabetic retinopathy. Invest Ophthalmol Vis Sci. 2000;41(7):1971-80.
- Arnoult D, Karbowski M, Youle RJ. Caspase inhibition prevents the mitochondrial release of apoptosis-inducing factor. Cell Death Differ. 2003;10(7):845-9.
- Jiang Z, Zhang Y, Chen X, et al. Activation of Erk1/2 and Akt in astrocytes under ischemia. Biochem Biophys Res Commun. 2002;294(3):726-33.
- Jiang H, Betancourt L, Smith RG. Ghrelin amplifies dopamine signaling by cross talk involving formation of growth hormone secretagogue receptor/dopamine receptor subtype 1 heterodimers. Mol Endocrinol. 2006;20(8):1772-85.
- Frago LM, Pañeda C, Dickson SL, Hewson AK, Argente J, Chowen JA. Growth hormone (GH) and GH-releasing peptide-6 increase brain insulin-like growth factor-I expression and activate intracellular signaling pathways involved in neuroprotection. Endocrinology. 2002;143(10):4113-22.
- Baserga R, Hongo A, Rubini M, Prisco M, Valentini SB 1997 The IGF-I receptor in cell growth, transformation and apoptosis. Biochim Biophys Acta 1332:F105–F126.
- Kulik G, Klippel A, Weber MJ 1997 Antiapoptotic signalling by the insulin-like growth factor I receptor, phosphatidylinositol 3-kinase and Akt. Mol Cell Biol 17:1595–1606.
- Chrysis D, Calikoglu AS, Ye P, D’Ercole AJ 2001 Insulin-like growth factor-I overexpression attenuates cerebellar apoptosis by altering the expression of Bcl family proteins in a developmentally specific manner. J Neurosci 21:1481–1489.
- Alessi DR, Andjelkovic M, Caudwell B, Cron P, Morrice N, Cohen P, Hemmings BA 1996 Mechanism of activation of protein kinase B by insulin and IGF-1. EMBO J 15:6541–6551.
- Dudek H, Datta SR, Franke TF, Birnbaum MJ, Yao R, Cooper GM, Segal RA, Kaplan DR, Greenberg ME 1997 Regulation of neural survival by the serine-threonine protein kinase Akt. Science 275:661–668.
- Mehrhof FB, Muller FU, Bergmann MW, Li P, Wang Y, Schmitz W, Dietz R, von Harsdorf R 2001 In cardiomyocyte hypoxia, insulin-like growth factor-I-induced antiapoptotic signaling requires phosphatidylinositol-3-OH-kinase-dependent and mitogen-activated protein kinase-dependent activation of the transcription factor cAMP response element-binding protein. Circulation 104:2088–2094.
- Gleichmann M, Weller M, Schuyltz JB 2000 Insulin-like growth factor-1-mediated protection from neuronal apoptosis is linked to phosphorylation of the pro-apoptotic protein BAD but not to inhibition of cytochrome c translocation in rat cerebellar neurons. Neurosci Lett 282:69–72.
- Peruzzi F, Prisco M, Dews M, Salomoni P, Grassilli E, Romano G, Calabretta B, Baserga R 1999 Multiple signaling pathways of the insulin-like growth factor 1 receptor in protection from apoptosis. Mol Cell Biol 19:7203–7215.
- Kulik G, Weber MJ 1998 Akt-dependent and -independent survival signaling pathways utilized by insulin-like growth factor I. Mol Cell Biol 18:6711–6718.
- Harada H, Andersen JS, Mann M, Terada N, Korsmeyer SJ 2001 p70S6 kinase signals cell survival as well as growth, inactivating the pro-apoptotic molecule BAD. Proc Natl Acad Sci USA 98:9666–9670.
- Desbois-Moutho C, Cadoret A, Blivet-Van Eggelpoel MJ, Bertrand F, Cherqui G, Perret C, Capeau J 2001 Insulin and IGF-1 stimulate the β-catenin pathway through two signalling cascades involving GSK-3β inhibition and Ras activation. Oncogene 20:252–259.
- Park BC, Kido Y, Accili D 1999 Differential signaling of insulin and IGF-1 receptors to glycogen synthesis in murine hepatocytes. Biochemistry 38:7517–7523.
- Cui H, Meng Y, Bulleit RF 1998 Inhibition of glycogen synthase kinase 3β activity regulates proliferation of cultured cerebellar granule cells. Brain Res Dev Brain Res 111:177–188.
- Tamatani M, Ogawa S, Nuñez G, Tokyama M 1998 Growth factors prevent changes in Bcl-2 and Bax expression and neuronal apoptosis induced by nitric oxide. Cell Death Differ 5:911–919.
- Baker NlL, Carlo Russo V, Bernard O, D’Ercole AJ, Werther GA 1999 Interactions between bcl-2 and the IGF-I system control apoptosis in the developing mouse brain. Brain Res Dev Brain Res 118:109–118.
- Du K, Montminy M 1998 CREB is a regulatory target for the protein kinase Akt/PKB. J Biol Chem 273:32377.
- Pugazhenthi S, Nesterova A, Sable C, Heidenreich KA, Boxer LM, Heasly LE, Reusch JE 2000 Akt/protein kinase B upregulates Bcl-2 expression through cAMP-response element-binding protein. J Biol Chem 275:10761–10766.
- Brod M, Pohlman B, Højbjerre L, Adalsteinsson JE, Rasmussen MH. Impact of adult growth hormone deficiency on daily functioning and well-being. BMC Research Notes. 2014;7:813. doi:10.1186/1756-0500-7-813.
- Maggi M, Buvat J, Corona G, Guay A, Torres LO. Hormonal causes of male sexual dysfunctions and their management (hyperprolactinemia, thyroid disorders, GH disorders, and DHEA). J Sex Med. 2013;10(3):661-77.
- Ginzburg E, Lin A, Sigler M, Olsen D, Klimas N, Mintz A. Testosterone and growth hormone normalization: a retrospective study of health outcomes. Journal of multidisciplinary healthcare. 2008;1:79-86.
- Brod M, Højbjerre L, Adalsteinsson JE, Rasmussen MH. Assessing the impact of growth hormone deficiency and treatment in adults: development of a new disease-specific measure. J Clin Endocrinol Metab. 2014;99(4):1204-12.
- Available at https://www.researchgate.net/publication/12600670_Effects_of_growth_hormone_on_male_reproductive_functions.
- Galdiero M, Pivonello R, Grasso LF, Cozzolino A, Colao A. Growth hormone, prolactin, and sexuality. J Endocrinol Invest. 2012;35(8):782-94.
- Becker AJ, Uckert S, Stief CG, et al. Possible role of human growth hormone in penile erection. J Urol. 2000;164(6):2138-42.
- Becker AJ, Uckert S, Stief CG, et al. Serum levels of human growth hormone during different penile conditions in the cavernous and systemic blood of healthy men and patients with erectile dysfunction. Urology. 2002;59(4):609-14.
- Otunctemur A, Ozbek E, Sahin S, et al. Low serum insulin-like growth factor-1 in patients with erectile dysfunction. Basic and Clinical Andrology. 2016;26:1. doi:10.1186/s12610-015-0028-x.
- Rajfer J. Growth Factors and Gene Therapy for Erectile Dysfunction. Reviews in Urology. 2000;2(1):34.
- Pastuszak AW, Liu JS, Vij A. IGF-1 levels are significantly correlated with patient-reported measures of sexual function. International journal of impotence research. 2011; 23(5):220-6.
- Pastuszak AW, Liu JS, Vij A, et al. IGF-1 levels are significantly correlated with patient-reported measures of sexual function. Int J Impot Res. 2011;23(5):220-6.
- El-Sakka AI, Lin CS, Chui RM, Dahiya R, Lue TF. Effects of diabetes on nitric oxide synthase and growth factor genes and protein expression in an animal model. Int J Impot Res. 1999;11:123–32. doi: 10.1038/sj.ijir.3900392.
- Soh J, Katsuyama M, Ushijima S, Mizutani Y, Kawauchi A, Yabe-Nishimura C, et al. Localization of increased insulin-like growth factor binding protein-3 in diabetic rat penis: Implications for erectile dysfunction. Urology. 2007;70:1019–23. doi: 10.1016/j.urology.2007.07.057.
- Pu XY, Zheng XG, Zhang Y, Xiao HJ, Xu ZP, Liu JM, et al. Higher expression of mRNA and protein of insulin-like growth factor binding protein-3 in old rat penile tissues: implications for erectile dysfunction. J Sex Med. 2011;8:2181–90. doi: 10.1111/j.1743-6109.2011.02318.x.
- Khorram O, Laughlin GA, Yen SS. Endocrine and metabolic effects of long-term administration of [Nle27]growth hormone-releasing hormone-(1-29)-NH2 in age-advanced men and women. J Clin Endocrinol Metab. 1997;82(5):1472-9.
- Rubinek T, Rubinfeld H, Hadani M, Barkai G, Shimon I. Nitric oxide stimulates growth hormone secretion from human fetal pituitaries and cultured pituitary adenomas. Endocrine. 2005;28(2):209-16.
- Valverde I, Peñalva A, Ghigo E, Casanueva FF, Dieguez C. Involvement of nitric oxide in the regulation of growth hormone secretion in dogs. Neuroendocrinology. 2001;74(4):213-9.
- Rigamonti AE, Cella SG, Marazzi N, Müller EE. Nitric oxide modulation of the growth hormone-releasing activity of Hexarelin in young and old dogs. Metab Clin Exp. 1999;48(2):176-82.
- Doi SQ, Jacot TA, Sellitti DF, et al. Growth hormone increases inducible nitric oxide synthase expression in mesangial cells. J Am Soc Nephrol. 2000;11(8):1419-25.
- Available at http://erj.ersjournals.com/content/31/4/815.
- Deniz Tuncel, Fatma Inanc Tolun, and Ismail Toru, “Serum Insulin-Like Growth Factor-1 and Nitric Oxide Levels in Parkinson’s Disease,” Mediators of Inflammation, vol. 2009, Article ID 132464, 4 pages, 2009.
- Available at https://clinicaltrials.gov/ct2/show/NCT00470002.
- Böger RH , Skamira C , Bode-Böger SM , Brabant G , von zur Muhlen A , Frolich JC. 1996. Nitric oxide may mediate the hemodynamic effects of recombinant growth hormone in patients with acquired growth hormone deficiency. A double-blind, placebo-controlled study. J Clin Invest 98:2706–2713.
- Thum T , Fleissner F , Klink I , Tsikas D , Jakob M , Bauersachs J , Stichtenoth DO. 2007. Growth hormone treatment improves markers of systemic nitric oxide bioavailability via insulin-like growth factor-I. J Clin Endocrinol Metab 92:4172–4179.
- Mani maran RR, Sivakumar R, Ravisankar B, et al. Growth hormone directly stimulates testosterone and oestradiol secretion by rat Leydig cells in vitro and modulates the effects of LH and T3. Endocr J. 2000;47(2):111-8.
- Ho KY, Evans WS, Blizzard RM, et al. Effects of sex and age on the 24-hour profile of growth hormone secretion in man: importance of endogenous estradiol concentrations. J Clin Endocrinol Metab. 1987;64(1):51-8.
- Argiolas A, Melis MR. Central control of penile erection: role of the paraventricular nucleus of the hypothalamus. Prog Neurobiol. 2005;76(1):1-21.
- Kim KS, Bae WJ, Kim SJ, et al. Improvement of erectile dysfunction by the active pepide from Urechis unicinctus by high temperature/pressure and ultra – wave assisted lysis in Streptozotocin Induced Diabetic Rats. International Brazilian Journal of Urology: official journal of the Brazilian Society of Urology. 2016;42(4):825-837. doi:10.1590/S1677-5538.IBJU.2015.0606.
- Wessells H, Blevins JE, Vanderah TW. Melanocortinergic control of penile erection. Peptides. 2005;26(10):1972-1977. doi:10.1016/j.peptides.2004.11.035.
- Melis MR, Argiolas A. Central oxytocinergic neurotransmission: a drug target for the therapy of psychogenic erectile dysfunction. Curr Drug Targets. 2003;4(1):55-66.
- Andersson KE. Mechanisms of penile erection and basis for pharmacological treatment of erectile dysfunction. Pharmacol Rev. 2011;63(4):811-59.
- Andersson KE. Pharmacology of penile erection. Pharmacol Rev. 2001;53(3):417-50.
- Decaluwé K, Pauwels B, Verpoest S, Van de voorde J. New therapeutic targets for the treatment of erectile dysfunction. J Sex Med. 2011;8(12):3271-90.
- Ryu B, Kim M, Himaya SWA, Kang KH, Kim SK. Statistical optimization of high temperature/pressure and ultra-wave assisted lysis of Urechis unicinctus for the isolation of active peptide which enhance the erectile function in vitro. Process Biochemistry. 2014;49:148–153.
- Liu Q, Jia Z, Duan L, Xiong J, Wang D, Ding Y. Functional peptides for cartilage repair and regeneration. American Journal of Translational Research. 2018;10(2):501-510.
- Hastar N, Arslan E, Guler MO, Tekinay AB. Peptide-Based Materials for Cartilage Tissue Regeneration. Adv Exp Med Biol. 2017;1030:155-166.
- Wang W, Rigueur D, Lyons KM. TGFbeta signaling in cartilage development and maintenance. Birth Defects Res C Embryo Today. 2014;102:37–51.
- Lam HJ, Li S, Lou N, Chu J, Bhatnagar RS. Synthetic peptides cytomodulin-1 (CM-1) and cytomodulin-2 (CM-2) promote collagen synthesis and wound healing in vitro. Conf Proc IEEE Eng Med Biol Soc. 2004;7:5028–5030.
- Basu S, Kumar M, Chansuria JP, Singh TB, Bhatnagar R, Shukla VK. Effect of Cytomodulin-10 (TGF-beta1 analogue) on wound healing by primary intention in a murine model. Int J Surg. 2009;7:460–465.
- Mittal A, Kumar R, Parsad D, Kumar N. Cytomodulin-functionalized porous PLGA particulate scaffolds respond better to cell migration, actin production and wound healing in rodent model. J Tissue Eng Regen Med. 2014;8:351–36.
- Shao Z, Zhang X, Pi Y, Wang X, Jia Z, Zhu J, Dai L, Chen W, Yin L, Chen H, Zhou C, Ao Y. Polycaprolactone electrospun mesh conjugated with an MSC affinity peptide for MSC homing in vivo. Biomaterials. 2012;33:3375–3387.
- Huang H, Zhang X, Hu X, Shao Z, Zhu J, Dai L, Man Z, Yuan L, Chen H, Zhou C, Ao Y. A functional biphasic biomaterial homing mesenchymal stem cells for in vivo cartilage regeneration. Biomaterials. 2014;35:9608–9619.
- Meng Q, Man Z, Dai L, Huang H, Zhang X, Hu X, Shao Z, Zhu J, Zhang J, Fu X, Duan X, Ao Y. A composite scaffold of MSC affinity peptide-modified demineralized bone matrix particles and chitosan hydrogel for cartilage regeneration. Sci Rep. 2015;5:17802.
- Shao Z, Zhang X, Pi Y, Yin L, Li L, Chen H, Zhou C, Ao Y. Surface modification on polycaprolactone electrospun mesh and human decalcified bone scaffold with synovium-derived mesenchymal stem cells-affinity peptide for tissue engineering. J Biomed Mater Res A. 2015;103:318–329.
- Webb DJ, Roadcap DW, Dhakephalkar A, Gonias SL. A 16-amino acid peptide from human alpha2-macroglobulin binds transforming growth factor-beta and platelet-derived growth factor-BB. Protein Sci. 2000;9:1986–1992.
- Shah RN, Shah NA, Del Rosario Lim MM, Hsieh C, Nuber G, Stupp SI. Supramolecular design of self-assembling nanofibers for cartilage regeneration. Proc Natl Acad Sci U S A. 2010;107:3293–3298.
- Chow LW, Armgarth A, St-Pierre JP, Bertazzo S, Gentilini C, Aurisicchio C, McCullen SD, Steele JA, Stevens MM. Peptide-directed spatial organization of biomolecules in dynamic gradient scaffolds. Adv Healthc Mater. 2014;3:1381–1386.
- Parmar PA, Chow LW, St-Pierre JP, Horejs CM, Peng YY, Werkmeister JA, Ramshaw JA, Stevens MM. Collagen-mimetic peptide-modifiable hydrogels for articular cartilage regeneration. Biomaterials. 2015;54:213–225.
- Recha-Sancho L, Semino CE. Heparin-based self-assembling peptide scaffold reestablish chondrogenic phenotype of expanded de-differentiated human chondrocytes. J Biomed Mater Res A. 2016;104:1694–1706.
- Yamaoka H, Asato H, Ogasawara T, Nishizawa S, Takahashi T, Nakatsuka T, Koshima I, Nakamura K, Kawaguchi H, Chung UI, Takato T, Hoshi K. Cartilage tissue engineering using human auricular chondrocytes embedded in different hydrogel materials. J Biomed Mater Res A. 2006;78:1–11.
- Kisiday J, Jin M, Kurz B, Hung H, Semino C, Zhang S, Grodzinsky AJ. Self-assembling peptide hydrogel fosters chondrocyte extracellular matrix production and cell division: implications for cartilage tissue repair. Proc Natl Acad Sci U S A. 2002;99:9996–10001.
- Ruoslahti E, Pierschbacher MD. Arg-Gly-Asp: a versatile cell recognition signal. Cell. 1986;44:517–518.
- Jeschke B, Meyer J, Jonczyk A, Kessler H, Adamietz P, Meenen NM, Kantlehner M, Goepfert C, Nies B. RGD-peptides for tissue engineering of articular cartilage. Biomaterials. 2002;23:3455–3463.
- Kim HD, Heo J, Hwang Y, Kwak SY, Park OK, Kim H, Varghese S, Hwang NS. Extracellular-matrix-based and Arg-Gly-Asp-modified photopolymerizing hydrogels for cartilage tissue engineering. Tissue Eng Part A. 2015;21:757–766.
- Frieboes RM, Murck H, Maier P, Schier T, Holsboer F, Steiger A. Growth hormone-releasing peptide-6 stimulates sleep, growth hormone, ACTH and cortisol release in normal man. Neuroendocrinology. 1995;61(5):584-9.
- Moreno-reyes R, Kerkhofs M, L’hermite-balériaux M, Thorner MO, Van cauter E, Copinschi G. Evidence against a role for the growth hormone-releasing peptide axis in human slow-wave sleep regulation. Am J Physiol. 1998;274(5 Pt 1):E779-84.
- Frieboes RM, Murck H, Antonijevic IA, Steiger A. Effects of growth hormone-releasing peptide-6 on the nocturnal secretion of GH, ACTH and cortisol and on the sleep EEG in man: role of routes of administration. J Neuroendocrinol. 1999;11(6):473-8.
- Morselli LL, Nedeltcheva A, Leproult R, et al. Impact of growth hormone replacement therapy on sleep in adult patients with growth hormone deficiency of pituitary origin. European journal of endocrinology/European Federation of Endocrine Societies. 2013;168(5):10.1530/EJE-12-1037. doi:10.1530/EJE-12-1037.
- Haqq AM, Stadler DD, Jackson RH, Rosenfeld RG, Purnell JQ, Lafranchi SH. Effects of growth hormone on pulmonary function, sleep quality, behavior, cognition, growth velocity, body composition, and resting energy expenditure in Prader-Willi syndrome. J Clin Endocrinol Metab. 2003;88(5):2206-12.
- Van cauter E, Copinschi G. Interrelationships between growth hormone and sleep. Growth Horm IGF Res. 2000;10 Suppl B:S57-62.
- Copinschi G, Nedeltcheva A, Leproult R, et al. Sleep disturbances, daytime sleepiness, and quality of life in adults with growth hormone deficiency. J Clin Endocrinol Metab. 2010;95(5):2195-202.
- Davidson JR, Moldofsky H, Lue FA. Growth hormone and cortisol secretion in relation to sleep and wakefulness. Journal of Psychiatry and Neuroscience. 1991;16(2):96-102.
- Moreno-reyes R, Kerkhofs M, L’hermite-balériaux M, Thorner MO, Van cauter E, Copinschi G. Evidence against a role for the growth hormone-releasing peptide axis in human slow-wave sleep regulation. Am J Physiol. 1998;274(5 Pt 1):E779-84.
- Shah N, Rice T, Tracy D, et al. Sleep and Insulin-Like Growth Factors in the Cardiovascular Health Study. Journal of Clinical Sleep Medicine : JCSM : Official Publication of the American Academy of Sleep Medicine. 2013;9(12):1245-1251. doi:10.5664/jcsm.3260.
- Mysliwiec V, Gill J, Matsangas P, Baxter T, Barr T, Roth BJ. IGF-1: a potential biomarker for efficacy of sleep improvement with automatic airway pressure therapy for obstructive sleep apnea?. Sleep Breath. 2015;19(4):1221-8.
- Izumi S, Ribeiro-filho FF, Carneiro G, Togeiro SM, Tufik S, Zanella MT. IGF-1 Levels are Inversely Associated With Metabolic Syndrome in Obstructive Sleep Apnea. J Clin Sleep Med. 2016;12(4):487-93.
- Izumi S, Ribeiro-Filho FF, Carneiro G, Togeiro SM, Tufik S, Zanella MT. IGF-1 Levels are Inversely Associated With Metabolic Syndrome in Obstructive Sleep Apnea. Journal of Clinical Sleep Medicine: JCSM: Official Publication of the American Academy of Sleep Medicine. 2016;12(4):487-493. doi:10.5664/jcsm.5672.
- Rusch HL, Gill JM. Effect of Acute Sleep Disturbance and Recovery on Insulin-Like Growth Factor-1 (IGF-1): Possible Connections and Clinical Implications. Journal of Clinical Sleep Medicine: JCSM: Official Publication of the American Academy of Sleep Medicine. 2015;11(10):1245-1246. doi:10.5664/jcsm.5108.
- Prinz PN, Moe KE, Dulberg EM, et al. Higher plasma IGF-1 levels are associated with increased delta sleep in healthy older men. J Gerontol A Biol Sci Med Sci. 1995;50(4):M222-6.
- Damanti S, Bourron O, Doulazmi M, et al. Relationship between sleep parameters, insulin resistance and age-adjusted insulin like growth factor-1 score in non diabetic older patients. Blondeau B, ed. PLoS ONE. 2017;12(4):e0174876. doi:10.1371/journal.pone.0174876.
- Obál F, Kapás L, Gardi J, Taishi P, Bodosi B, Krueger JM. Insulin-like growth factor-1 (IGF-1)-induced inhibition of growth hormone secretion is associated with sleep suppression. Brain Res. 1999;818(2):267-74.
- Chennaoui M, Drogou C, Sauvet F, Gomez-merino D, Scofield DE, Nindl BC. Effect of acute sleep deprivation and recovery on Insulin-like Growth Factor-I responses and inflammatory gene expression in healthy men. Eur Cytokine Netw. 2014;25(3):52-7.
- Rasmussen MH, Wildschiødtz G, Juul A, Hilsted J. Polysomnographic sleep, growth hormone insulin-like growth factor-I axis, leptin, and weight loss. Obesity (Silver Spring). 2008;16(7):1516-21.
- Levada OA, Troyan AS. Insulin-like growth factor-1: a possible marker for emotional and cognitive disturbances, and treatment effectiveness in major depressive disorder. Annals of General Psychiatry. 2017;16:38. doi:10.1186/s12991-017-0161-3.
- Peterfi Z, McGinty D, Sarai E, Szymusiak R. Growth hormone-releasing hormone activates sleep regulatory neurons of the rat preoptic hypothalamus. American Journal of Physiology – Regulatory, Integrative and Comparative Physiology. 2010;298(1):R147-R156. doi:10.1152/ajpregu.00494.2009.